 产业资讯
产业资讯
 医药观澜
医药观澜  2025-05-10
2025-05-10
 671
671
5月8日,中国国家药监局药品审评中心(CDE)官网最新公示,麓鹏制药申请的洛布替尼片拟纳入优先审评,适用于既往接受过布鲁顿氏酪氨酸激酶(BTK)抑制剂治疗的成人套细胞淋巴瘤(MCL)患者。公开资料显示,这是麓鹏制药在研的第四代BTK抑制剂。
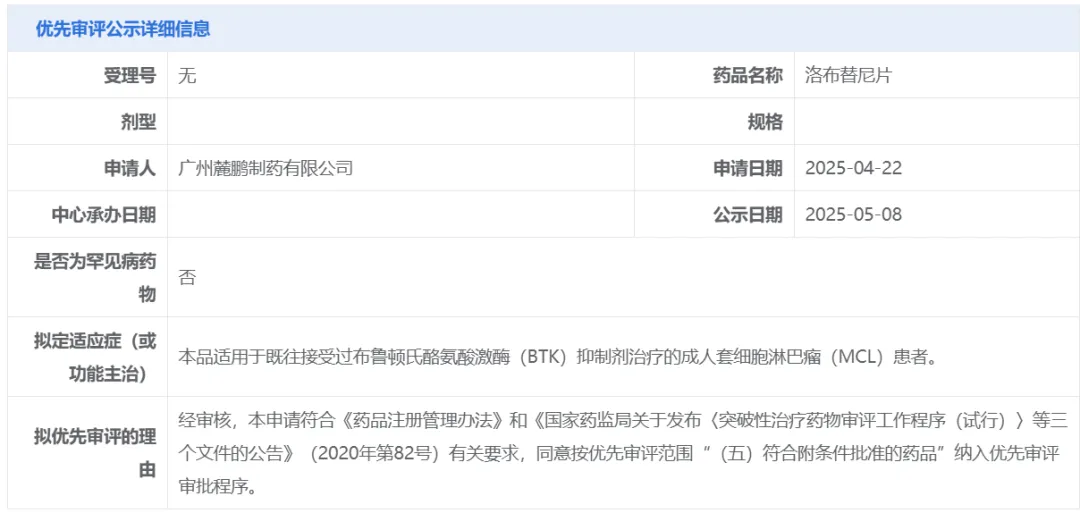
截图来源:CDE官网
套细胞淋巴瘤(MCL)是一种严重威胁患者生命的疾病。BTK抑制剂的应用是近些年R/R MCL治疗上重要的进展,患者缓解率较高,且安全性较好。但绝大部分患者终将出现疾病进展,耐药问题日趋显著。针对共价结合的BTK抑制剂(cBTKi)治疗失败的MCL患者,临床仍然缺少治疗方案。
据麓鹏制药公开资料介绍,洛布替尼(rocbrutinib,LP-168)是一款共价兼非共价BTK抑制剂,该产品具有独特的双结合模式:与野生型BTK的共价结合和与突变BTK的可逆结合。其不仅能克服第1/2/3代BTK抑制剂的耐药,而且在活性、选择性和药代动力学(PK)方面都有提高。该药正在开展的临床适应症包括各类B细胞淋巴瘤,主要有MCL、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、边缘区淋巴瘤(MZL)和弥漫大B细胞淋巴瘤(DLBCL)等。

洛布替尼治疗复发/难治性套细胞淋巴瘤患者的1期研究结果此前入选了2023年美国血液学会(ASH)年会。截止2023年5月31日,研究共招募了33例R/R MCL患者,中位接受过2线治疗(范围:1-11),其中24.2%为前线治疗方案复发的患者。所有患者均接受过利妥昔单抗或含利妥昔单抗治疗方案的治疗。有19例(57.6%)患者至少接受过1种cBTKi或含cBTKi治疗方案。
疗效方面,在31例疗效可评估患者中,24例(77.4%)获得缓解,包括12例(38.7%)CMR(完全代谢缓解)/CR(完全缓解)。值得关注的是,在17例接受过cBTKi治疗的患者中,有12例(70.6%)获得缓解,其中6例(35.3%)达到CMR。LP-168在接受过2种以上cBTKi治疗的2例患者中也显示出疗效。研究人员认为,新一代BTK抑制剂LP-168在R/R MCL患者中表现出高CR率和持续的疗效,且安全性良好。此外,LP-168可以有效地克服对既往cBTKi治疗的获得性耐药。
基于LP-168在1期研究中获得的安全性和有效性数据,CDE同意以ROCK-1研究为关键性注册研究支持LP-168在目标人群中的附条件上市申请。ROCK-1是一项开放标签、多中心的单臂2期研究,旨在评估洛布替尼在cBTKi治疗失败的中国复发或难治性MCL患者中的疗效、安全性、耐受性和药代动力学。符合条件的MCL受试者必须既往接受过至少一种BTK抑制剂治疗失败或缓解后复发或不耐受。在本项研究中,主要终点是独立评审委员会(IRC)根据2014版Lugano淋巴瘤疗效标准评估的总体缓解率(ORR)。
值得一提的是,2024年8月,翰森制药与麓鹏制药宣布就洛布替尼签署合作协议。翰森制药获得了洛布替尼所有非肿瘤适应症在中国的研发、注册、生产及商业化的权益。同时,翰森制药将支付首付款和研发、注册及基于销售的商业化里程碑潜在付款合计不超过7.29亿元人民币。

 产业资讯
产业资讯
 药时代
药时代  2025-11-06
2025-11-06
 1
1

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 33
33

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 33
33