 医改专题
医改专题
 UmabsDB
UmabsDB  2025-06-09
2025-06-09
 1443
1443
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
近期,根据UmabsDB数据库的记录,安进制药在clinical trials网站上,登记了一项DLL-3/CD3双抗药物Tarlatamab,联合PD-1抗体Durvalumab,以及铂类化疗Carboplatin和Etoposide,在一线广泛期小细胞肺癌患者中,启动一项三期头对头临床研究NCT07005128(DeLLphi-312),该临床将于2025年6月启动,计划入组330例患者。
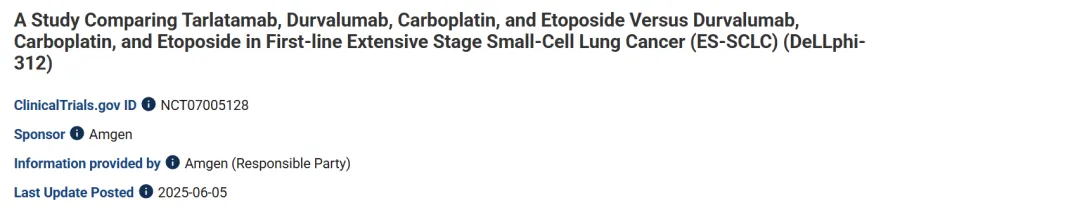

该项临床试验组Tarlatamab+Durvalumab+Carboplatin+Etoposide,对照组为Durvalumab+Carboplatin+Etoposide,主要临床终点为OS。
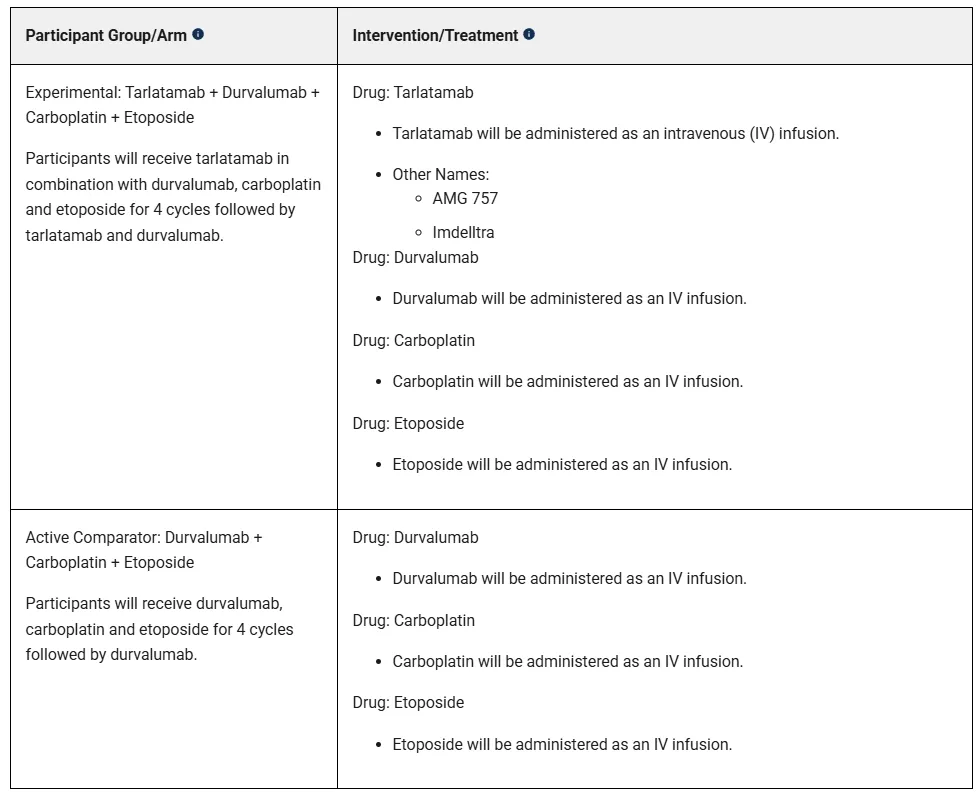
一年前安进已经在一线广泛期小细胞肺癌患者中启动了首项三期临床试验DeLLphi-305,在Platinum+Etoposide+Durvalumab的诱导治疗后,在维持治疗阶段,进行Tarlatamab+Durvalumab联用疗法和Durvalumab单药疗法对比,和Lurbinectedin的一线三期临床IMforte设计一致(小细胞肺癌之夜:一线二线治疗相继突破),而本次DeLLphi-312显然进一步将Tarlatamab前移至诱导阶段。
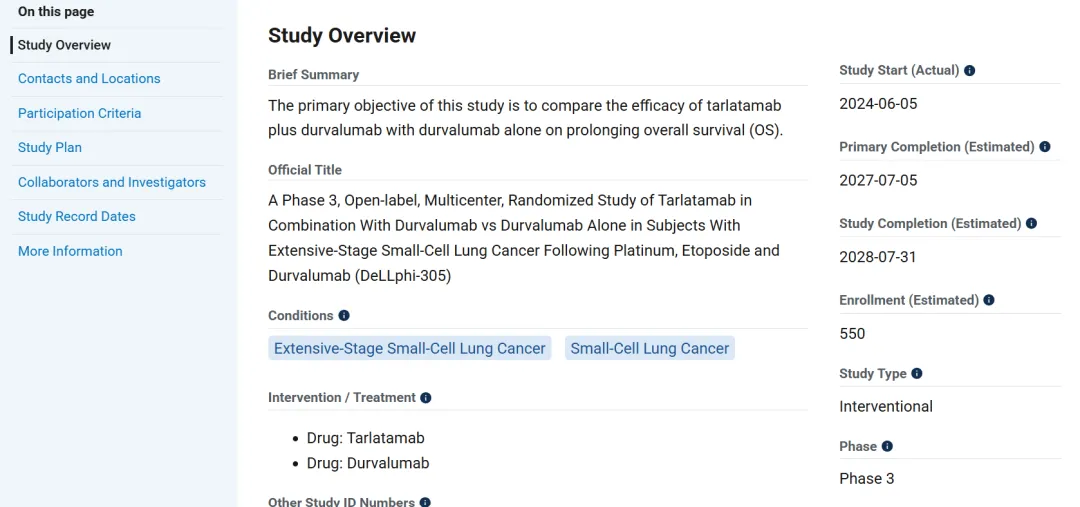
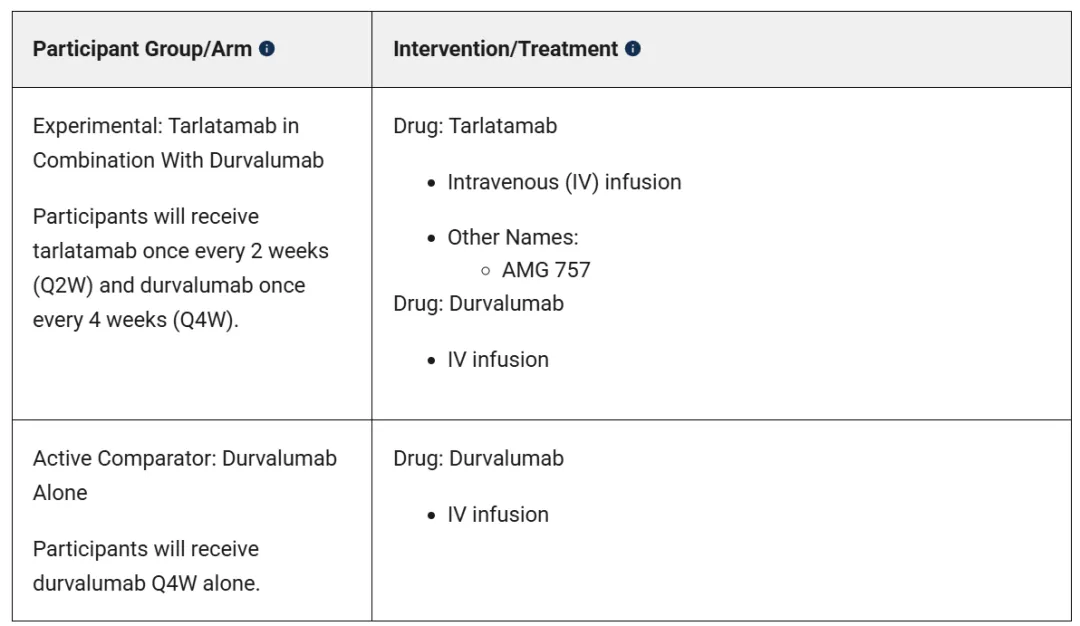
Tarlatamab是全球首款批准上市的DLL3疗法,其不仅迎来小细胞肺癌治疗30年来的新突破,也同时为TCE双抗治疗实体瘤带来了新的曙光。

加上本次启动的三期临床,Tarlatamab已经启动了四项三期临床试验,从局限限期的,到广泛期的一二线治疗进行了全面覆盖,有望实现小细胞肺癌治疗的全面突破。

本次ASCO年会期间,安进更是公布了其首个三期临床DeLLphi-304结果,进一步确立了Tarlatamab在二线小细胞肺癌治疗中的优势地位,同时相关研究同步发表于NEJM期刊上。

这项3期试验在全球30个国家的166个中心进行,共随机分配了509名患者接受Tarlatamab(254名)或化疗(255名)。化疗方案包括拓扑替康、卢比替康或阿柔比星。
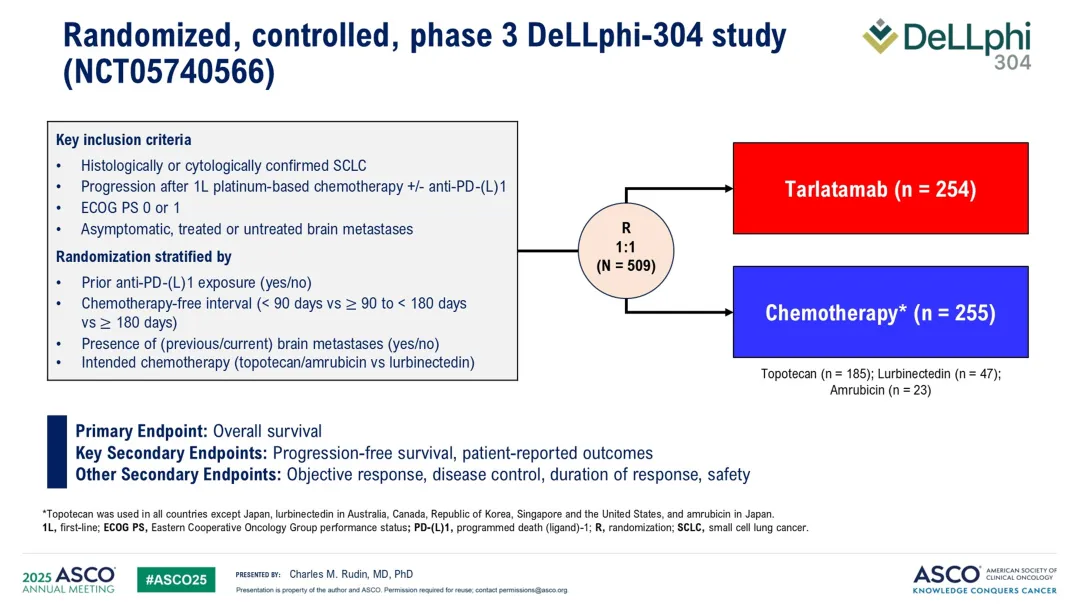
主要终点是总生存期,关键次要终点包括研究者评估的无进展生存期和患者报告结果。患者报告结果使用欧洲癌症研究和治疗组织生活质量问卷(EORTC
QLQ-C30)和13项肺癌模块进行评估。统计分析计划包括意向治疗分析集和安全性分析集。
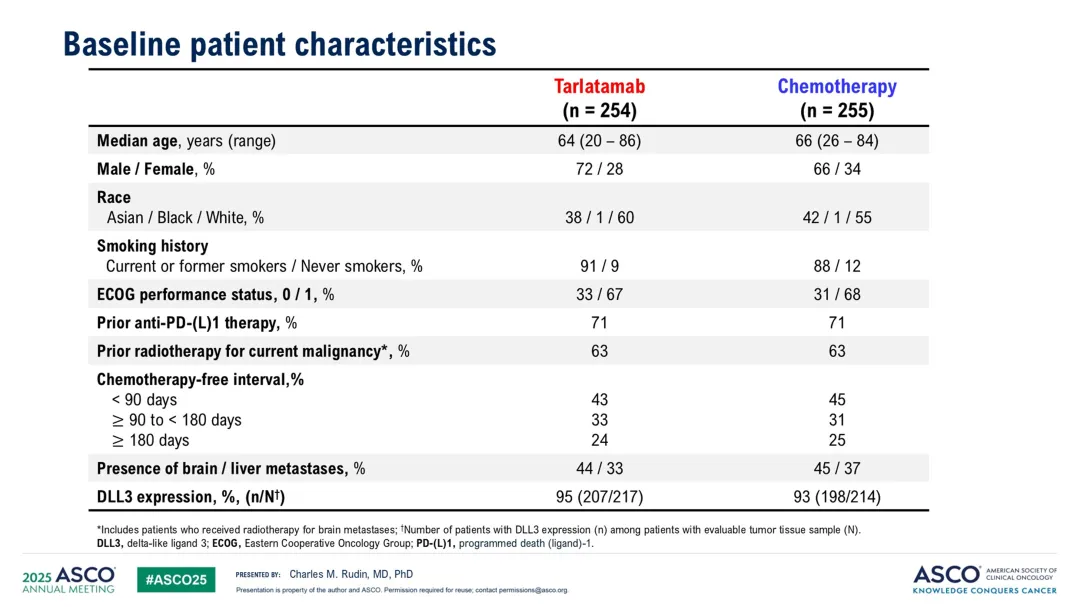
共688名患者接受了资格评估,其中509名被随机分配。两组患者的基线特征一致,中位年龄65岁,45%的患者有脑转移,71%接受过PD-L1或PD-1抑制剂治疗,44%为铂类耐药疾病。
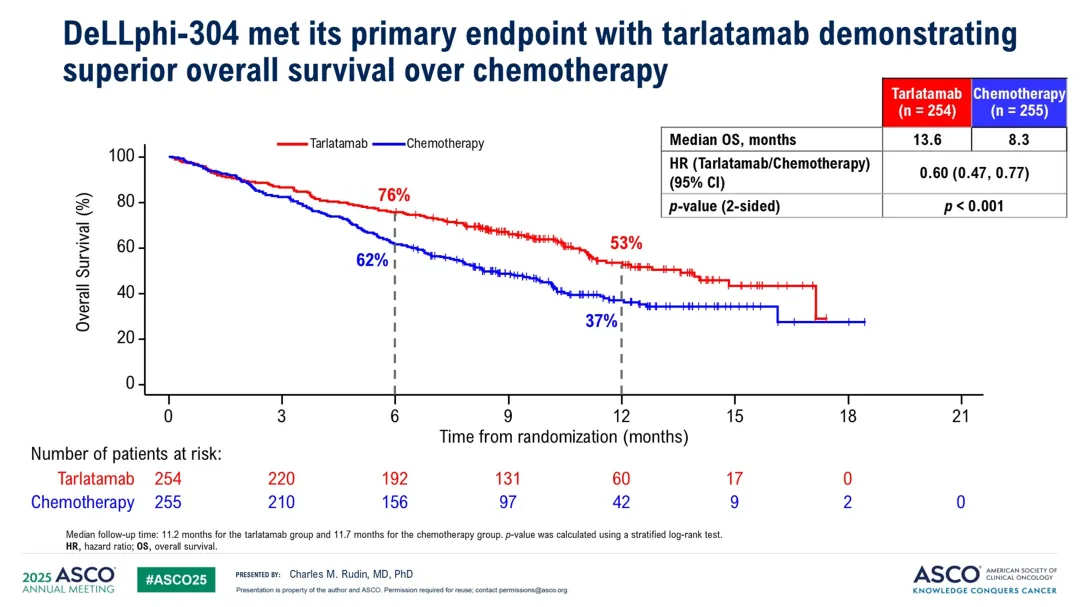
总生存期方面:Tarlatamab组的中位总生存期为13.6个月(95% CI, 11.1至未达到),化疗组为8.3个月(95% CI,
7.0至10.2),分层风险比为0.60(95% CI, 0.47至0.77;P<0.001)。
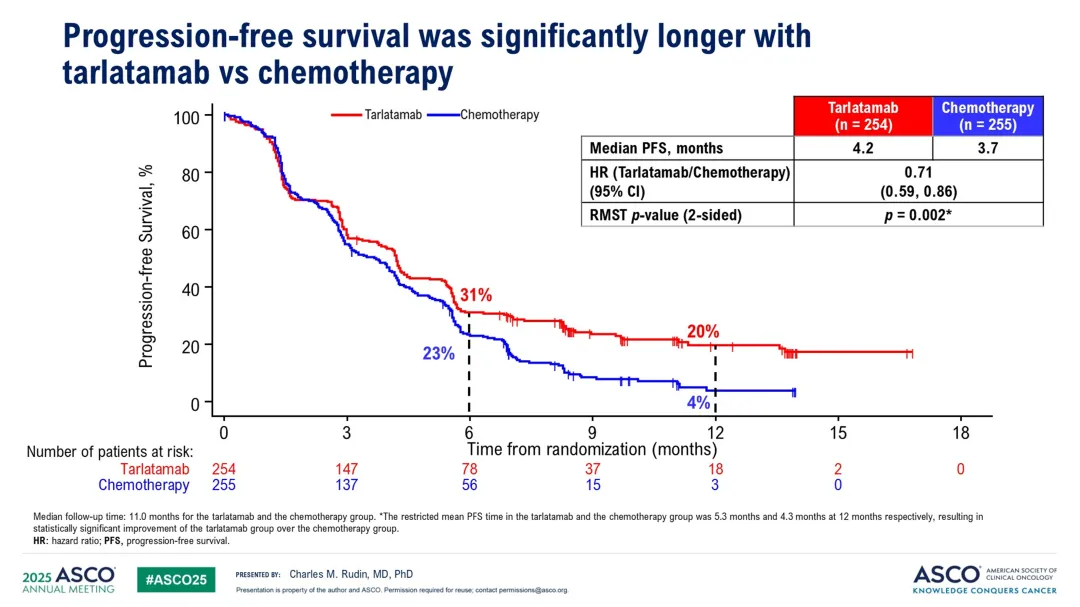
无进展生存期方面:Tarlatamab组的中位无进展生存期为4.2个月(95% CI, 3.4至4.5),化疗组为3.7个月(95% CI,
2.9至4.2)。使用限制平均生存时间方法分析,Tarlatamab组在12个月时的估计值为5.3个月,化疗组为4.3个月(P=0.002)。
客观反应方面:Tarlatamab组的客观反应率为35%(95% CI, 29至41),化疗组为20%(95% CI,
16至26),风险比为1.73(95% CI, 1.29至2.33)。
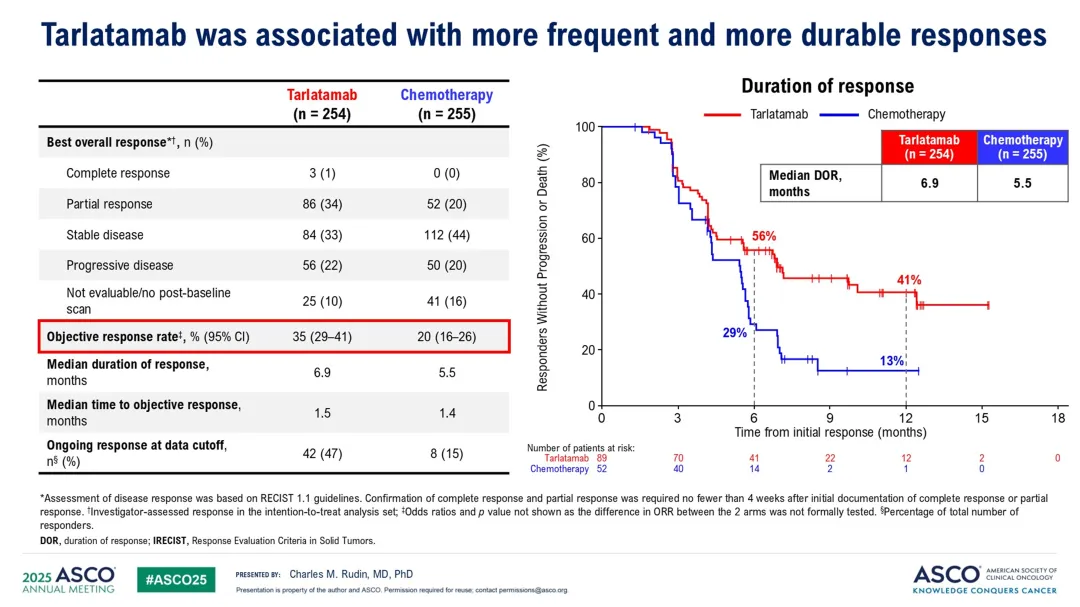
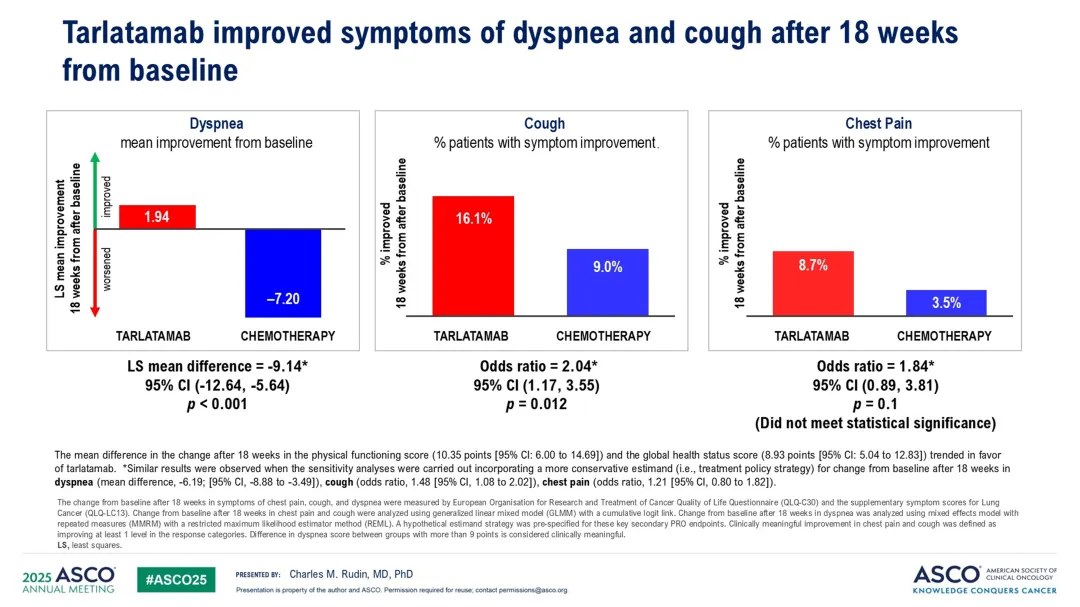
患者报告结果:Tarlatamab组在缓解呼吸困难和咳嗽方面显著优于化疗组,但在胸痛方面差异不显著。由于层次测试策略,未对身体功能和全球健康状况进行正式测试。
安全性方面:Tarlatamab组3级及以上不良事件发生率为54%,化疗组为80%。治疗相关不良事件在Tarlatamab组和化疗组的发生率分别为93%和91%,但Tarlatamab组3级及以上事件发生率较低。Tarlatamab组最常见的3级及以上治疗相关不良事件包括中性粒细胞减少症(4%)、淋巴细胞减少症(4%)等。
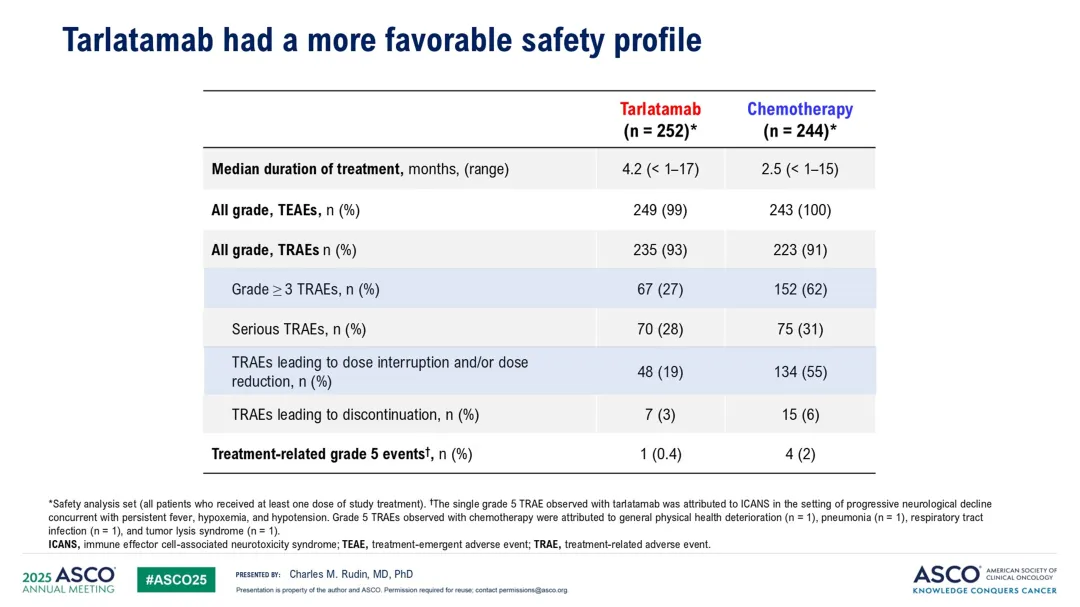
化疗组最常见的3级及以上治疗相关不良事件包括贫血(28%)、中性粒细胞减少症(22%)等。Tarlatamab组的细胞因子释放综合征(CRS)发生率为56%,大多数为低级别,且未导致频繁的治疗中断或停药。
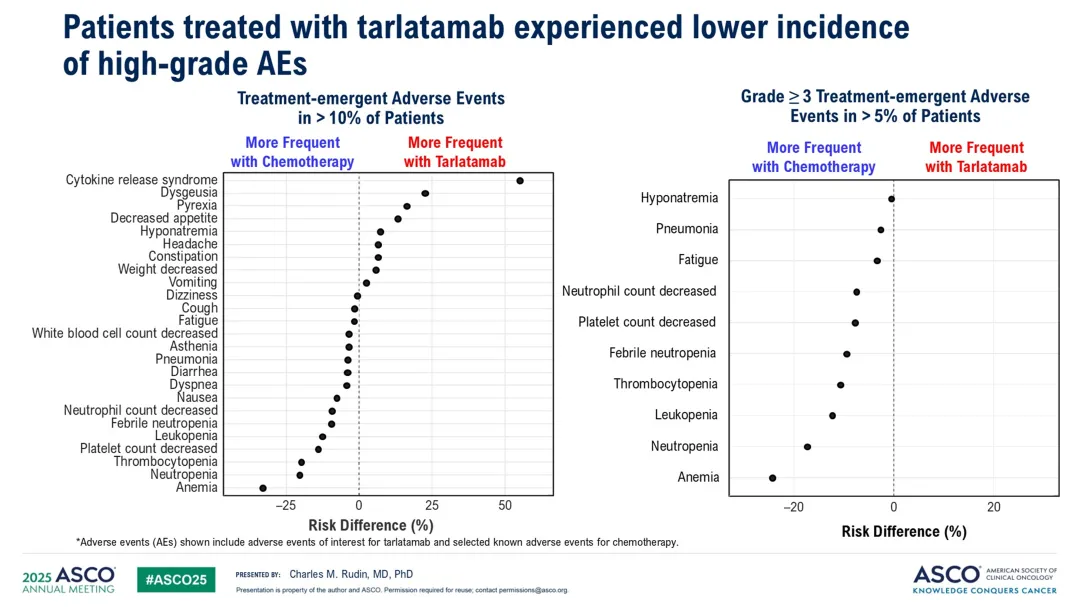
神经毒性事件在Tarlatamab组的发生率为56%,化疗组为35%,其中免疫效应细胞相关神经毒性综合征(ICANS)在Tarlatamab组的发生率为6%,大多数为低级别。
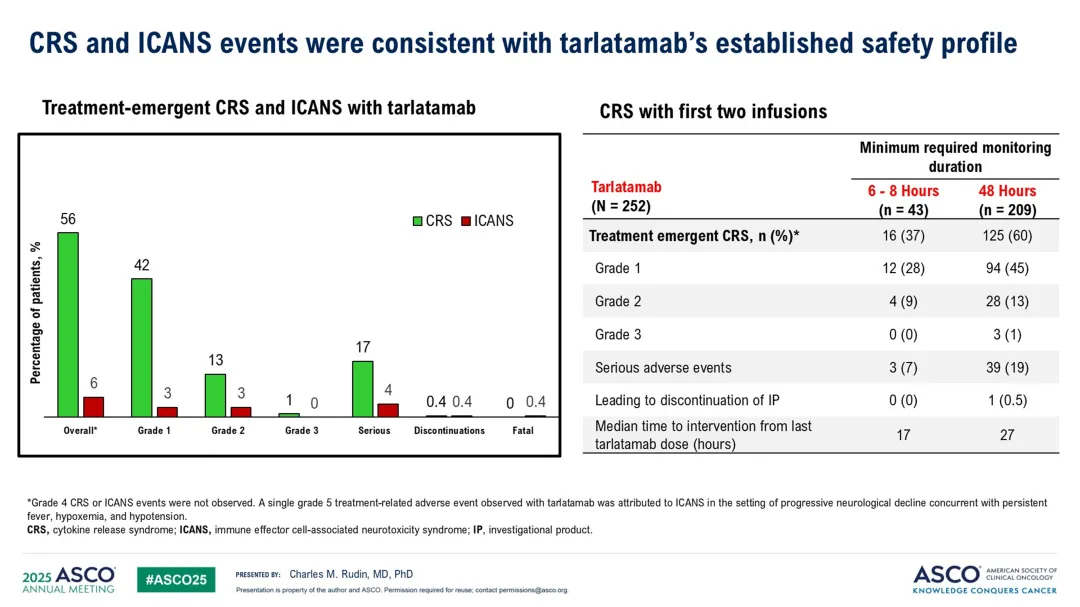
从DeLLphi-304来看,Tarlatamab治疗在总生存期、无进展生存期和患者报告结果方面均优于化疗,且不良事件发生率较低。这些结果支持Tarlatamab作为铂类化疗后进展的小细胞肺癌患者的治疗选择。
研究的局限性包括开放标签设计和对患者群体的代表性有限,但其优势在于使用总生存期作为主要终点,并纳入了铂类耐药和脑转移等预后不良因素的患者,成为三十年细胞肺癌二线治疗新的突破,期待其更多临床捷报。
原文链接:

 医改专题
医改专题
 赛柏蓝
赛柏蓝  2026-02-28
2026-02-28
 131
131
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-27
2026-02-27
 172
172
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-26
2026-02-26
 220
220