 产业资讯
产业资讯
 药渡
药渡  2025-06-12
2025-06-12
 152
152
PART.
01
明年FDA用户费用
首次超过国会拨款
在2025年6月5日通过的众议院拨款法案中,美国国会拟给予FDA比白宫请求更多的财政预算自主权,这一举动为当前对FDA角色、独立性与运作机制的辩论再添一层政治与政策色彩。
根据法案内容,众议院提议为FDA在2026财年提供32.0亿美元的预算授权资金(budget authority),比特朗普政府提出的31.7亿美元多出3310万美元,而FDA的整体预算总额将在66.8亿美元左右,其中有34.8亿美元来自各类“用户付费”(user fees)。这一安排意味着用户付费收入首次超过非用户付费预算,占FDA运作资金的多数,这在FDA历史上极为罕见,也使“行业是否控制FDA”这一长期争议再度升温。
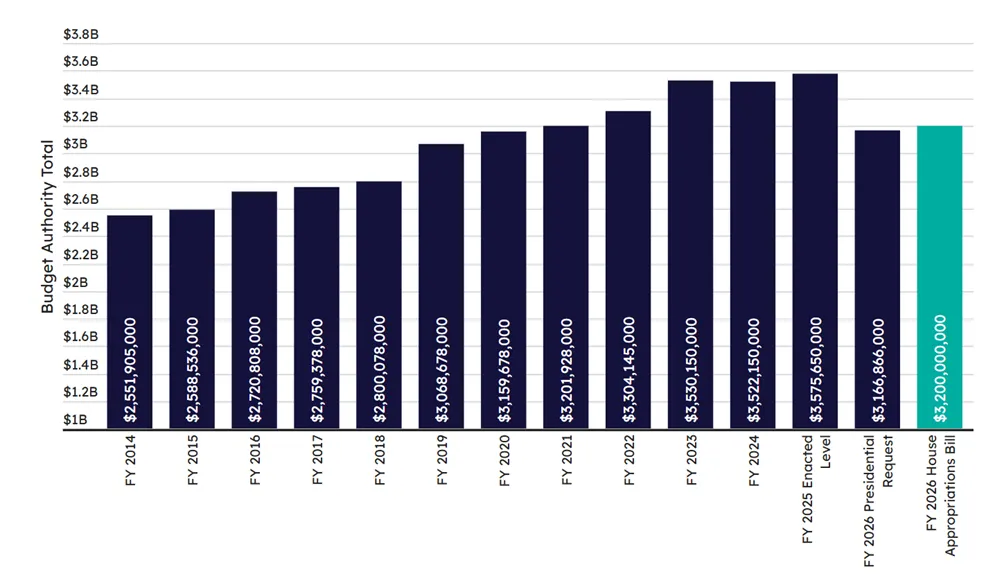
图1. 2014–2026财年FDA非用户付费预算授权总额变化趋势,来源:Pink Sheet
从图1的非用户付费预算授权款(Budget Authority)项来看, FDA的非用户付费预算授权总额自2014财年以来总体呈上升趋势:
2014财年仅为25.5亿美元;
至2024财年增长至35.2亿美元;
2025财年的实际执行水平为35.8亿美元;然而,特朗普政府在2026财年的预算请求大幅下降至31.7亿美元,比前一年削减约11%;
相比之下,众议院2026年拨款法案中提议为FDA提供32亿美元,虽未完全恢复至2025年水平,但比总统请求多出3310万美元。
这一趋势反映出FDA近年来核心财政支持不断增强,但2026年面临潜在回撤的风险,也暴露了用户付费在FDA整体资金结构中的比重正在持续上升。
美国卫生与公众服务部长小罗伯特·F·肯尼迪此前多次批评FDA受制于制药行业资助,并公开表示有意取消FDA用户付费机制。然而,倘若取消而没有等额替代拨款,FDA核心职能将面临运作危机,尤其是在新药审评和设施检查等高度依赖资源的环节。
更为严峻的是,特朗普政府递交的2026财年预算请求本就削减FDA经费至67.6亿美元(含非用户和用户费用),比2025财年下降3.9%(约2.7亿美元),并建议将FDA雇员编制从20593人降至16875人,裁员幅度高达18%。这一请求遭到了民主党议员的坚决反对。众议员Sanford Bishop和Lauren Underwood在6月5日的小组会议中,表达了对FDA预算削减的强烈质疑。
这一轮预算案的核心,不仅在于资金增减本身,更体现了FDA在政治拉扯、科学独立性与公众信任之间的复杂处境。无论最终结果如何,该案都预示着FDA在未来一年将面临前所未有的外部压力与内部重组挑战。
PART.
02
人不够 AI凑
FDA审评流程迎来技术性飞跃

图2. FDA部署人工智能工具,来源:AI生成
在传统审评流程面临人力紧张与数据激增双重压力的背景下,FDA开始尝试以人工智能作为内部改革的突破口。2025年6月初,FDA正式宣布部署其首个生成式人工智能工具Elsa(Enterprise-level Scientific Assistant),这标志着FDA在数字化转型道路上迈出了实质性的一步。
该AI系统由FDA内部技术团队开发,运行于Amazon GovCloud环境,目的在于提升科学审评效率、释放人工资源、强化数据处理能力。与公众所熟知的ChatGPT类工具不同,Elsa并不“对话”用户,而是深入嵌入到FDA内部多个核心工作流程中,提供结构化分析和草拟辅助。
据FDA官员介绍,Elsa当前已应用于以下几个关键审评场景:
新药上市申请(NDA)与生物制品许可申请(BLA)初筛:帮助提取临床数据要点、比对历史审批先例、预警潜在合规缺口;
临床试验协议审查:自动识别伦理审批缺项、统计分析不完整之处,辅助快速生成审查意见;
药品标签(labeling)一致性检查:对比说明书中关键表述与法规数据库条文,显著减少人工比对时间;
药品安全事件回顾(pharmacovigilance reports):在药品不良反应报告中筛查“信号”,提高评估敏感度;
包装插页文件版本比对:自动识别修订前后文本差异,降低重复劳动。
在试点阶段,Elsa已展现出显著效率提升。例如,一项原本需三天才能完成的临床协议文本评审,在AI协助下可在数分钟内初步完成结构解读与重点提取,供审评员进一步验证与判断。尽管如此,FDA也特别强调:Elsa仅作为辅助工具,所有最终审评意见与批准决定仍由人类专家作出。
当前,Elsa已覆盖药品审评中心(CDER)和生物制品审评中心(CBER)部分工作单元,FDA计划在2025年6月30日前全面部署至全机构。这一时间表显示出FDA在AI转型路径上的决心,也反映出其对于数据驱动型监管模式的高度认可。
在全球监管机构纷纷尝试数字化改革的当下,美国FDA率先完成AI原生系统的内部部署,既为解决审评堆积与人才紧缺问题提供了现实手段,也预示着“人机协同”将成为未来药品监管的重要范式。如何在效率提升的同时确保透明性、公正性与科学性,将是接下来FDA必须面对的新课题。
PART.
03
资金不稳动摇根基
FDA审评吸引力正在流失
如果说预算拨款和用户付费体系构成了FDA的“造血机制”,那么其真正的竞争力体现在全球医药企业对其监管效率与科学标准的信任上。然而,这种信任正因资金的不确定性与组织动荡而受到侵蚀。
2025年以来,FDA在人员架构、管理风格与预算机制上的一系列剧烈变动,已经对其审评职能造成实际影响。随着高层更替与裁员推进,部分审评中心(尤其是生物制品评审中心CBER与医疗器械中心CDRH)出现了沟通延迟、审批停滞与责任不清的局面,导致企业在关键节点难以获得清晰的监管反馈。
在这种不确定氛围中,越来越多的早期生物技术公司正考虑将I期临床试验从美国转移至欧洲、加拿大或澳大利亚等地区。这些国家在近年来持续优化临床试验启动流程,同时提供更加可预测的审批窗口。例如,澳大利亚通过其“clinical trial notification”机制大幅压缩审批周期,欧洲部分国家则借助EMA框架推进跨境试验协同。
Siren Biotechnology在FDA CBER前主任Peter Marks离职后,决定重新评估其I期临床策略,优先考虑将试验转移至欧洲和澳大利亚;
Dare Bioscience的首席执行官Sabrina Martucci Johnson表示,当前的不确定性已促使公司选择在欧洲率先推进部分产品的临床开发;
一家匿名的肿瘤类生物技术公司则选择同步在三个欧洲国家申请EMA批准开展I期试验,尽管这一策略带来了约100万美元的额外文件、咨询和CRO支出,以及数百万美元的运营成本;
另一家企业则直接将两个I期项目迁往澳大利亚,明确表示FDA裁员与评审延迟是其主要原因,尽管澳洲的成本本就比美国低30%至40%。
正如一家企业CEO所言:“我们不能只是寄希望于FDA裁员不会影响业务。真正的风险在于时间,而我们没有多余的资本缓冲审批的拖延。”
尽管这些公司多数仍计划在后期将产品递交FDA申请上市,但早期研发的外迁本身,已足以改变美国在全球临床开发中的主导地位。正如伦敦风投公司4BIO Capital合伙人Owen Smith指出:“欧洲虽然慢,但它赢在了稳定。”
对初创企业而言,监管反馈延迟不仅意味着项目时间表被打乱,更直接影响到融资节奏与生存空间。在资本紧缩的大环境下,即便是几周的监管失误,也可能导致整个企业倒下。
FDA作为全球监管体系的“标杆”,正因其内部资金机制与治理不稳,被迫让出在“早期临床生态系统”中的部分主导权。
PART.
04
公共信任体系的裂痕
从FDA到CDC的制度动荡
2025年6月,卫生部长小罗伯特·F·肯尼迪出人意料地宣布,罢免美国CDC(美国疾病控制与预防中心)疫苗咨询委员会(ACIP)全部17名成员,并计划重组该委员会。此举立即引发医学界震荡,特别是在当前儿童疫苗接种率下滑、麻疹疫情重燃的背景下。
小肯尼迪表示,此举旨在“重建公众对疫苗政策的信任”,并强调科学应通过“透明且无利益冲突”的机制指导政策制定。但此举被广泛视为对CDC科学机制独立性的打击,美国医学会主席Bruce Scott直言,这将“破坏一个建立在科学与透明机制之上的可信体系”。
尽管CDC作为独立于FDA的公共卫生机构,其疫苗政策不由FDA直接主导,但此次政治干预事件所传递出的系统性信号,仍对FDA构成深远影响。它揭示出美国卫生与公众服务部(HHS)内部监管系统正面临更大程度的政治不确定性,FDA在其中的制度独立性、科学权威性和公众信任将更易受到侵蚀。
PART.
05
财政结构之下的制度分岔口
FDA未来走向何方?

图3. 分岔路口的FDA,来源:AI生成
在过去数十年里,FDA以其科学严谨、公正高效的监管体系,确立了在全球医药开发中的黄金标准地位。然而,2025年以来持续的财政不确定性、组织动荡与技术改革,正将这家机构推向一个制度性分岔口。
一方面,预算拨款低于预期、用户付费体系动摇、人员流失与组织重构同步发生,让FDA的运作基础出现结构性松动;另一方面,机构内部虽主动部署AI工具以提效转型,却难以掩盖背后的资源紧张与运行压力。这种“高技术、低信任”的矛盾状态,尤其在临床早期开发阶段,已开始显性化为企业外迁与策略调整。
更值得警惕的是,FDA当前面临的不仅是单点挑战,而是三重风险的交汇:
财政来源的结构性不稳:用户付费依赖加剧,国会拨款成为博弈筹码;
监管能力的内部分化:大型药企与中小Biotech在应对监管不确定性方面出现“资源不对称”;
全球信任秩序的再配置:欧洲、澳大利亚等市场正在承接美国监管失衡的“溢出效应”。
短期内,这些问题可能被新一轮预算补贴或管理调整暂时缓解,但从更长周期看,FDA亟需重塑三项核心机制:
稳定且透明的财政支持模式:减少对行业用户付费的过度依赖,恢复公共资助比例;
有计划的技术转型策略:让AI赋能成为“增强人力”,而非替代组织;
强化监管-产业信任链:尤其在Biotech早期沟通、程序可预测性和专家持续陪伴等方面。
结 语
毕竟,监管不仅是“程序”,更是“公信力”;审批不只是“节点”,更是“生态”。如果一个国家最具权威的药品监管机构都不能保证自身制度的稳定与连贯,那整个生物医药产业的创新基础将不可避免地受到侵蚀。
FDA仍然拥有全球领先的科学资源与制度遗产,但它必须在财政与信任的双重重构中,作出清晰而果敢的选择。

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 33
33

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 31
31

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 33
33