 政策法规
政策法规
 药闻资讯
药闻资讯  2025-08-01
2025-08-01
 2377
2377
今日(7月30日),CDE连发4个指导原则,涉及临床研究和药学研究:(1)《药物暴露-效应关系研究技术指导原则》(2)《发酵或半合成化学仿制药抗生素有关物质限度制定指导原则》(3)《罕见疾病药物临床药理学研究技术指导原则》(4)《模型引导的罕见疾病药物研发技术指导原则》
我们依次来了解下上述4个指导原则。
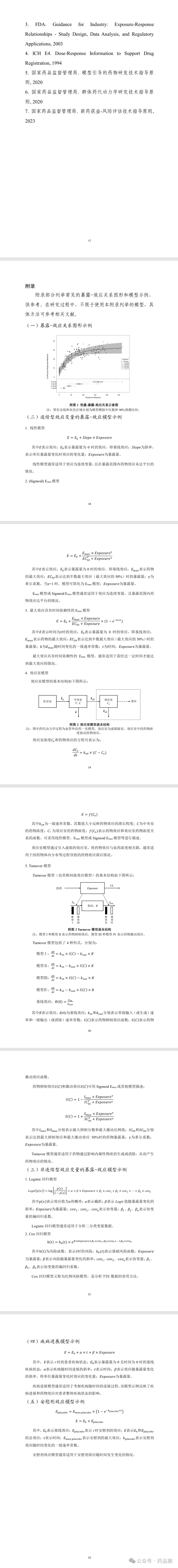
(一)《药物暴露-效应关系研究技术指导原则》

为推动创新药物高质量发展,进一步规范和指导新药研发中科学合理地开展暴露-效应关系研究,药审中心组织起草了《药物暴露-效应关系研究技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:药物暴露-效应关系研究技术指导原则
国家药监局药审中心
2025年7月8日



(二)《发酵或半合成化学仿制药抗生素有关物质限度制定指导原则》

为进一步明确发酵或半合成化学仿制药抗生素有关物质限度制定研究技术要求,完善化学仿制药抗生素评价标准体系,按照国家药品监督管理局的工作部署,药审中心组织制定了《发酵或半合成化学仿制药抗生素有关物质限度制定指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。特此通告。
附件:发酵或半合成化学仿制药抗生素有关物质限度制定指导原则
国家药监局药审中心
2025年7月3日



(三)《罕见疾病药物临床药理学研究技术指导原则》

为指导罕见疾病药物研发过程中科学合理开展临床药理学研究,从而支持和合理加速罕见疾病药物上市,药审中心组织制定了《罕见疾病药物临床药理学研究技术指导原则》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:罕见疾病药物临床药理学研究技术指导原则
国家药监局药审中心
2025年6月15日




(四)《模型引导的罕见疾病药物研发技术指导原则》

为指导申办者在罕见疾病药物研发过程中有效应用定量药理学方法,以及科学合理设计定量药理学研究,药审中心组织制定了《模型引导的罕见疾病药物研发技术指导原则》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:模型引导的罕见疾病药物研发技术指导原则
国家药监局药审中心
2025年6月15日




 政策法规
政策法规
 NCCGCP1962
NCCGCP1962  2026-02-27
2026-02-27
 342
342

 政策法规
政策法规
 医药地理
医药地理  2026-01-31
2026-01-31
 1357
1357

 政策法规
政策法规
 2026-01-27
2026-01-27
 1639
1639