 会员动态
会员动态
 丁香园Insight数据库
丁香园Insight数据库  2025-11-18
2025-11-18
 405
405
2025 年美国血液学会(ASH)年会将于当地时间 12 月 6 日到 12 月 9 日在美国佛罗里达州奥兰多市召开,目前常规摘要已经公布。
齐鲁制药将在本次会议上首次公布下一代 GPRC5D×BCMA×CD3 三抗 QLS4131 在复发或难治性多发性骨髓瘤(RRMM)患者中首次人体试验的初步研究结果。

截图来源:ASH 官网
QLS4131 是一款 BCMA/GPRC5D/CD3 三抗。临床前数据显示,与对标品相比,QLS4131 对多发性骨髓瘤细胞系表现出更高的亲和力,能够有效清除双靶点(BCMA 和 GPRC5D)和单靶点(BCMA 或 GPRC5D)表达的肿瘤细胞,其肿瘤细胞杀伤活性显著高于对标品。
这是一项评价 QLS4131 在 RRMM 患者中的安全性、耐受性、药代动力学、免疫原性以及初步有效性的 I 期临床研究(NCT06500507)。
在「剂量递增阶段」,齐鲁制药招募了那些患有可测量的 RRMM 且在现有治疗后病情出现进展或无法耐受现有治疗的患者。剂量递增包括:
静脉注射(IV)剂量从 0.06 µg/kg 递增至 30 µg/kg,每周一次(QW)给药;
皮下注射(SC)剂量从 30 µg/kg 递增至 600 µg/kg,每两周一次(Q2W)给药。
患者在首次目标剂量(从 3 µg/kg 剂量水平开始)之前会接受 1 或 2 次递增剂量(SUD),以减轻细胞因子释放综合征(CRS)。
截至 2025 年 7 月 15 日,共有 17 名患者接受了 QLS4131 治疗,剂量范围为 0.06 至 30 µg/kg(IV,QW)。此外,另有 3 名入组患者接受了 30 µg/kg 的 QLS4131 治疗(SC,Q2W)。
患者的中位年龄为 59 岁,中位既往治疗线数为 3。其中 64.7% 的患者曾接受过 3 线及以上的治疗,35% 的患者曾接受过干细胞移植。
结果显示,在 ≥1 µg/kg 剂量组中观察到了反应。在 15 名接受 QLS4131 静脉注射治疗且符合反应评估标准的患者中,ORR 为 60%(≥VGPR 40%)。在 30 µg/kg 剂量组中,100% 的患者达到 VGPR 及以上的缓解。
此外,在 10 µg/kg 静脉注射剂量组中,有 2 名患者先前接受过 BCMA 靶向的 CAR-T/CAR-NK 治疗而失败,目前其中 1 例达到严格意义上的完全缓解 (SCR),另 1 例达到部分缓解 (PR)。
安全性方面,QLS4131 具有总体可控的耐受性。未出现剂量限制毒性反应(DLT),也未达到最大耐受剂量(MTD)。最常见的治疗相关不良事件(TRAE)为血细胞减少和 CRS,CRS 的总体发生率为 80%。未出现免疫效应细胞相关神经毒性综合征(ICANS)。
研究者得出结论,QLS4131 毒性可耐受,未观察到 DLT,且与竞争对手 (如强生 JNJ-79635322) 公布的数据相比,GPRC5D 相关不良反应的发生率较低。主要疗效数据表明,即使在低剂量水平下也观察到了积极的反应。该试验仍在进行中,MTD、RP2D 以及 DLT 还需确定。
Insight 数据库显示,全球在研的 GPRC5D×BCMA×CD3 三抗共有 13 款,6 款已经进入临床阶段,分别来自天广实(MBS314)、信达(IBI3003)、齐鲁(QLS4131)、先声药业/艾伯维(SIM0500)、强生(JNJ-79635322)。
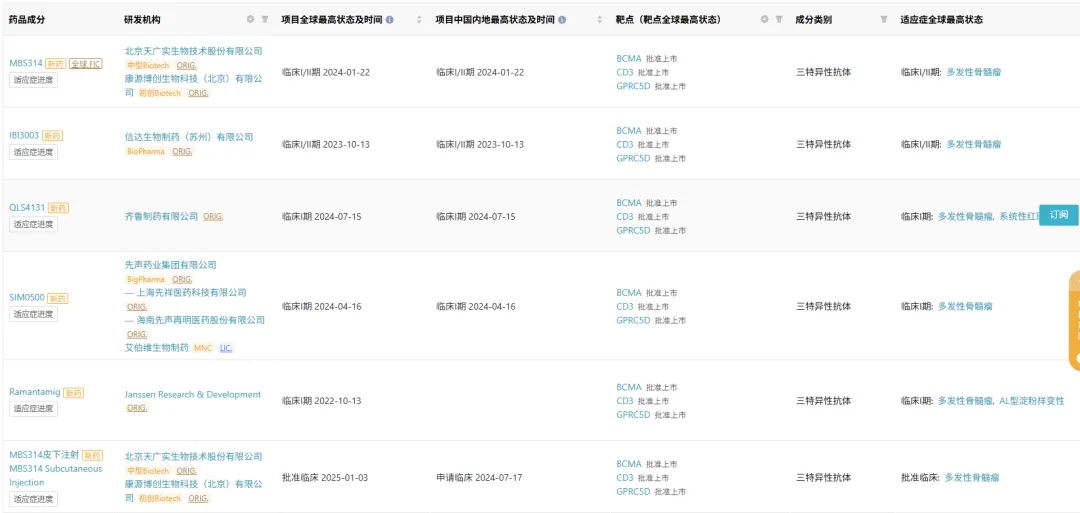
截图来源:Insight 数据库

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 158
158

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 157
157

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 178
178