 医改专题
医改专题
 药闻天下
药闻天下  2025-12-20
2025-12-20
 937
937
历史总是惊人的相似,但这一次,风暴的中心从临床数据移向了药学研究(CMC)。
2015年的7月22日,一纸公告引发了中国医药史上著名的“临床数据自查核查惨案”,无数品种主动撤回,行业为之巨震。时隔十年,在2025年的岁末,相似的一幕正在药审中心(CDE)的后台悄然上演。
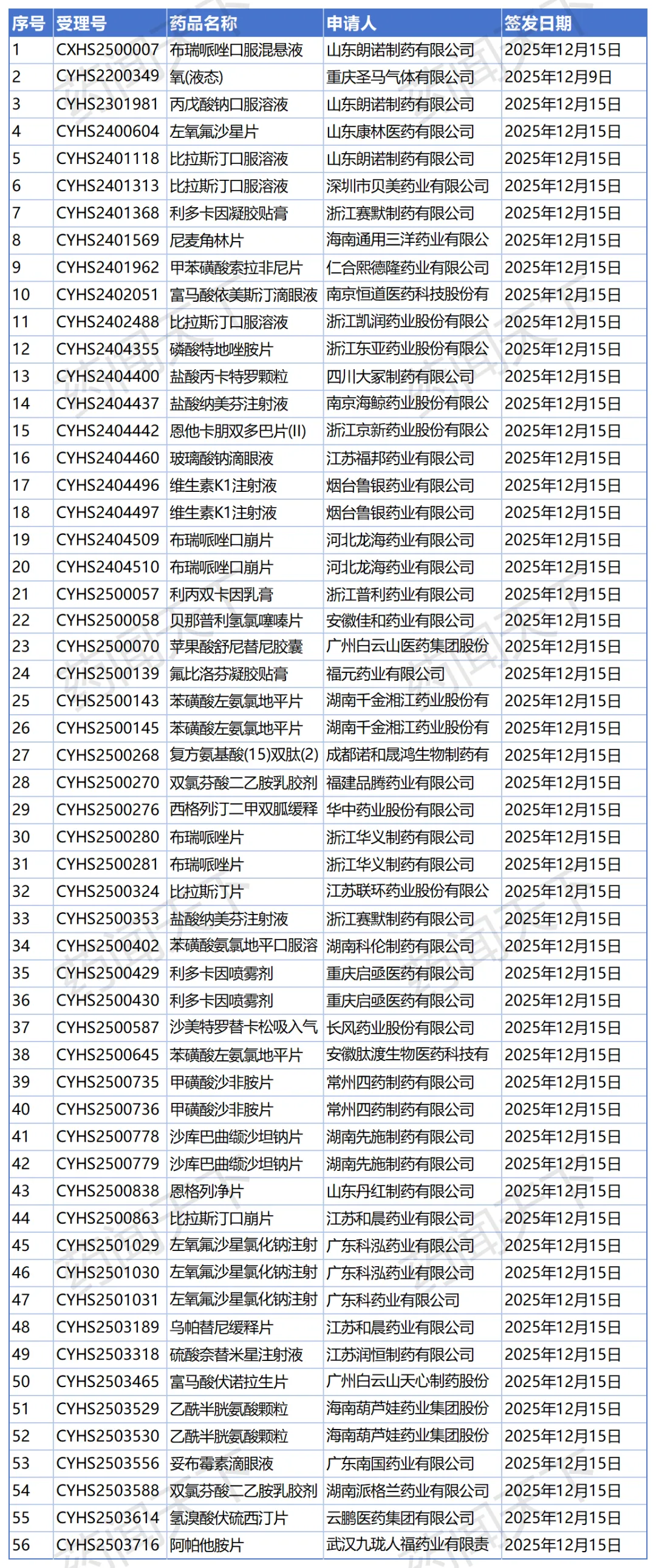
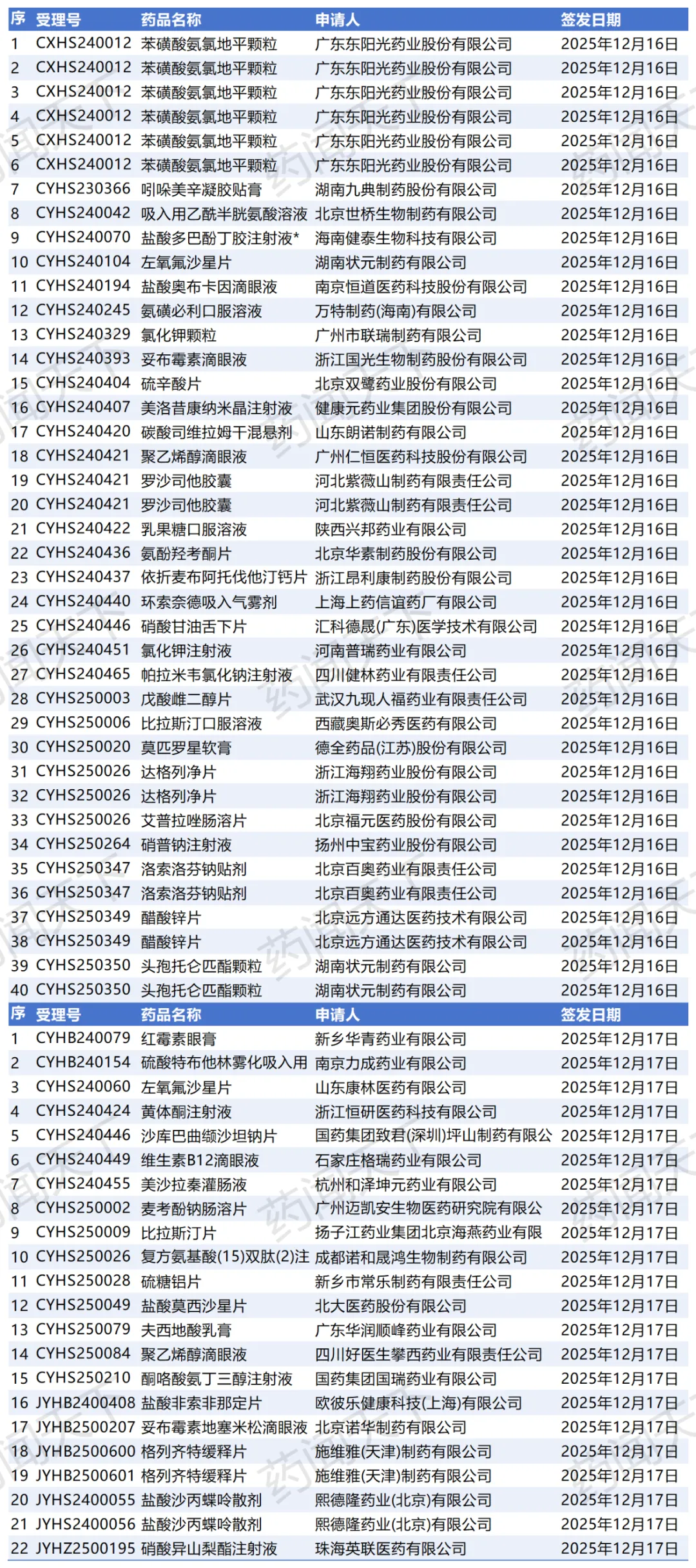
根据国家药监局政务服务门户的最新送达信息,12月16日至18日,短短3天内,合计高达118个药品注册申请收到了“药品通知件”。在行内人都懂的语境里,这些密集的“通知件”而非“注册证”,通常意味着不批准或者企业被迫主动撤回。
这不是年底的例行清理,而是一场关于仿制药质量的“大洗牌”。结合此前业内流传的《化学仿制药药学研究重大缺陷(试行)(征求意见稿)》,我们可以断定:“CMC版的722”已经来了。
这三份看似普通的行政送达名单,背后确实代表了中国医药企业至少10个亿人民币的真金白银投入。这还不包括那些在研发途中失败、未能拿到受理号的“沉没成本”。对于行业而言,这既是技术实力的展示,也是极其残酷的资金消耗战。
整理:药闻天下
01
62张“劝退函”:
大户撤退,巨头折戟?
翻开这三天的送达名单,信息的密度让人窒息。这118个受理号背后,没有赢家,只有监管层划下的鲜红底线。
1. 数据的震撼:从“点杀”到“团灭”
据统计,12月16日送达56件 ,12月17日送达40件 ,12月18日送达22件 。这一波次的处理量之大、频率之高,实属罕见。
2. 巨头的折戟:没有“免死金牌”
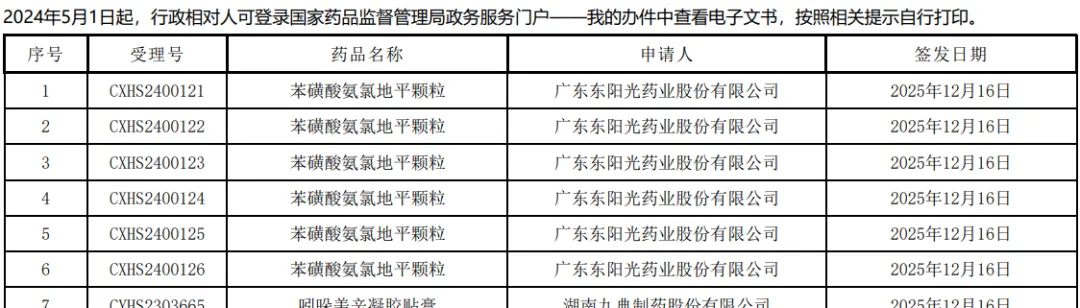
最令人瞩目的是国内仿制药巨头广东东阳光药业。在17日的名单中,该企业申报的6个苯磺酸氨氯地平颗粒受理号(CXHS2400121-126)全数收到了通知件 。作为2.2类改良型新药,这6个号的集体“翻车”,极有可能是未能证明较片剂有明显的临床优势,或因为在颗粒剂的稳定性或杂质控制上未能优于原研,触碰了新规红线。
跨国药企(MNC)也未能幸免。北京诺华制药的妥布霉素地塞米松滴眼液(JYHB2500207)
、施维雅(天津)的格列齐特缓释片(JYHB2500600/601) 均在18日的名单之列。
这释放了一个强烈的信号:在新的审评尺度下,无论是国产龙头还是外资原研地产化,只要药学研究存在重大缺陷,一视同仁。
3. 剂型的全面覆盖
这次“清洗”不分剂型。从简单的口服固体制剂如左氧氟沙星片(山东康林,12月16日/18日均有通知) ,到高技术壁垒的吸入制剂(如北京世桥的吸入用乙酰半胱氨酸溶液 、长风药业的沙美特罗替卡松吸入气雾剂 ),再到复杂注射剂(如健康元的美洛昔康纳米晶注射液 ),无一幸免。
02
监管“明牌”:
没有补考,只有“死刑”
为什么会有这波“清洗”?答案就藏在《重大缺陷意见稿》里。
以前做仿制药,很多企业的策略是“先占坑,后补票”。资料先报上去,有问题等发补(CDE提出补充资料要求)时再凑数据,甚至寄希望于通过沟通交流来“解释”掉缺陷。
但《重大缺陷意见稿》的发布,彻底堵死了这条路。文件明确列出了多项直接导致“核查不通过”或“无法评价”的情形。现在的逻辑是:一旦触碰红线,直接退审,不给补考机会。
详见此篇分析:CDE连发两文划定“致死”红线!以下情况,直接退审!(含17年立卷标准&2025对比)
看看这份“死亡清单”里都写了什么:
数据“连坐”:如果你为了省事,不同申请共用了研究数据(原辅包研究、处方开发、对照品研究),一旦被发现逻辑不通或无法溯源,直接定性为重大缺陷。
工艺“锁死”:审评期间,如果你发现工艺不行,想变更生产工艺?对不起,这往往意味着“需要重新生产新的批次并重新进行稳定性考察” 。在以前,这可能只是一个补充资料的过程,但现在,这被列为“重大缺陷”,意味着你得撤回重报。很多企业习惯在审评期间调整工艺。但现在,如果审评期间发生重大工艺变更,往往意味着“需要重新生产并重新进行稳定性考察”。这对于已经在审评排队的项目来说,时间成本等同于重新申报。于是,CDE直接发通知件,让你撤回重做,别浪费行政资源。
杂质“零容忍”:如果你的原料药或制剂,杂质分析方法不合理、不可行,或者出现了超限杂质且理由不充分,直接判负。
这62个通知件,其中部分很可能就是《重大缺陷意见稿》精神的提前预演。对于那些申报资料不完整、试图用小试规模冒充中试规模、或者杂质研究甚至不如参比制剂的“凑数”项目,监管层不再陪跑,而是直接亮了红牌。
此外,还有“必杀技”正在生效:
以东阳光的苯磺酸氨氯地平颗粒为例,作为改良型新药,如果其杂质谱或稳定性数据不能证明“不低于”原研片剂,甚至因为改剂型带来了新的风险(如吸湿性增加),在新的审评体系下,这就是“重大缺陷”。监管层不再接受“差不多”,只接受“更优”或“等同”。
而且核心是改良型新药的核心必须体现“临床优势”。如果改剂型(如从片剂改为颗粒)导致了杂质谱恶化或稳定性风险增加,且没有带来明显的临床获益(如显著提高依从性或安全性),在当前的审评体系下确实属于重大缺陷,极大概率会被拒批。
03
价值重塑:告别“弯道超车”,拼的是“硬核速度”
这波“退审潮”,对行业意味着什么?
1. “弯道超车”的时代结束了
过去几年,很多药企讲究“唯快不破”,为了抢首仿、抢集采资格,往往在药学研究上走捷径,牺牲质量换速度,试图在审评过程中“弯道超车”。
过去十年,我们讲究“唯快不破”,抢首仿、抢集采。很多企业在药学研究(CMC)上能省则省。现在的局面是:你跑得再快,如果CMC基础不牢,终点等着你的不是批文,而是退审函。此次扬子江海燕(比拉斯汀片 )、白云山(富马酸伏诺拉生片 )等大厂品种的折戟,说明即使是成熟的大企业,若在具体品种上稍有懈怠,也无法过关。
2.这是一场“供给侧改革”。
2天62个“阵亡”名单,实际上是在为剩下的、合规的批文“镀金”。
有人担心这会推高药价,其实不然。在医保控费的大背景下,药价很难大幅上涨。但是,批文的“含金量”变了。
以前,手里有几十个批文可能只是一堆废纸;
以后,能拿出来的每一个有效批文,都意味着它经受住了堪比原研的“炼狱级”考验。
这是一种供给侧的改革。通过清理掉那些“占坑”的低质产能,让真正具备研发实力、工艺稳健、数据真实的企业活下来。
3. 供应链的“连坐”风险
关联审评下,原料药和制剂是命运共同体。原料药供应商的任何缺陷,都会直接引爆制剂的退审。
04
结语
2015年的“722”,让中国临床数据回归真实;2025年的这场“CMC风暴”,将让中国仿制药回归质量本源。
118个通知件,只是冰山一角。它宣告着一个时代的结束:那个靠拼凑数据、甚至稍微动点歪脑筋就能拿批文的草莽时代,彻底翻篇了。
对于医药人而言,冬天虽然寒冷,但瑞雪兆丰年。只有挤干了水分的批文,才能承载起中国医药高质量发展的未来。

 医改专题
医改专题
 赛柏蓝
赛柏蓝  2026-02-28
2026-02-28
 112
112
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-27
2026-02-27
 154
154
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-26
2026-02-26
 201
201