 产业资讯
产业资讯
 研发客
研发客  2026-02-10
2026-02-10
 225
225
CDE对生物统计学评审工作越来越重视,除了希望统计专家苏炳华教授参与统计学审评工作,还要求他培养年轻人。陈峰、姚晨、夏结来等就是苏炳华陆续培养并参与审评工作的专业人员。
在宽敞明亮的会议厅里,一场聚焦RCT的讲座正在如火如荼地进行。南京医科大学生物统计专家陈峰教授的讲解精辟入微,语言风趣幽默。课后不时有同学慕名请教,还有学生拿着他的著作请他签名。
陈峰多年执教,与我国知名生物统计专家夏结来教授、姚晨教授等一起见证了中国药物临床试验生物统计事业的发展历程。如今进入AI制药时代,他强调“生物统计的作用并不会减少,因为AI的底层逻辑恰恰是概率和统计学”。
在课程间隙,陈峰他回顾了我国药物临床试验生物统计的曲折发展。他推了一下眼镜,面带微笑感慨道:“那是一段充满迷茫与探索的岁月。”
艰难起步
1985年,国家卫生部成立了药品审评委员会,下设药品审评办公室,其职能为新药技术审评,审评模式以外部专家审评为主。由此,我国药品技术审评机制正式起步,原各省的药品评审职能也陆续收归中央,由国家药监局统一审评。
1993年,药品审评办公室更名为卫生部药品审评中心,有专门的人员编制,开始向专业化审评机构转型,内部技术审评能力得到逐步强化。但药品审评中心没有专门的统计学审评员,生物统计还未纳入国家药品评审工作。可以说,“那是一段充满迷茫与探索的岁月。”陈峰回忆起我国生物统计发展的初期时如此感慨说。1996年之前,国家药品审评中心设在卫生部,但当时的统计学审评工作是由药理学专家兼任的,药品审评在全国各省独立开展,国家对生物统计重视不足,统计在临床试验中仍然属于从属地位。
当时,陈峰说,国内对非劣效试验、等效性试验、ITT(即意向性分析,Intention-to-Treat)等概念没有太多的认知,药品审评主要是针对仿制药,当时规定等效性试验每组60例,扩大适应症可以进行开放入组,不需要随机化。“那个时候,大家普遍认为,P值大于0.05就表明两组等效,分析方法非常原始。”
这种局面,随着苏炳华教授从英国爱丁堡大学第二次学习归来而发生了转变。
当时苏炳华教授是上海第二医科大学(现上海交通大学医学院)生物统计教研室主任,1996年学成归国后受邀参加CDE的统计学审评工作,这也成为我国生物统计发展的一个重要里程碑。
“他的归来,推动了CDE生物统计评审工作的发展和后来部门的创建。”陈峰回忆道,“苏老师性格开朗、幽默风趣、平易近人,很快就和CDE的审评人员打成一片。CDE的周思源和高晨燕等当时都是审评员,与苏老师合作十分密切,感情也很深,他们勤勉好学,一有机会就向苏老师请教统计学问题。他们为了搞清楚随机化与盲法是如何实施的,多次来到随机编盲现场观摩。”
CDE对生物统计学评审工作也越来越重视,除了希望苏炳华教授参与统计学审评工作,还要求他培养年轻人。陈峰、姚晨、夏结来等就是苏炳华陆续培养并参与审评工作的专业人员。
1997年,ICH E9临床试验统计学原则(Statistical principles for clinical trials)进入公众咨询阶段(stage 2),CDE迅速成立了以苏炳华为组长的中国临床试验生物统计学指导原则起草小组,成员包括统计学专家金丕焕、陈启光、陈峰等,还有药理学专家桑国卫、金正钧、孙瑞元,以及部分有临床试验丰富经验的PI如丁德云等,共同研究学习国际先进统计理念和方法。

然而,起草生物统计学指导原则是一项艰巨的任务。陈峰说:“当时很多术语都不理解,我们请教了国外药企专家,包括沈志华、谭凌实、黄克欧等,才弄明白其含义。”
1998年,ICH E9正式发布(stage 4),苏炳华教授带领起草小组立即着手翻译和研究,努力理解其概念和技术要求。高晨燕等将生物统计学指导原则翻译成中文并在国内发表。
1999年国庆前,CDE的起草小组在北京长安街妇女活动中心召开了生物统计学指导原则定稿会,专家学者提供了大量的意见和建议。经过两年努力,到1999年底,起草小组完成了中国指导原则初稿。这一初稿引发了热烈讨论。
2002年,基于前期反馈和修订,国家药监局出版《化学药品和治疗用生物制品研究指导原则(试行)》,当中特别提及了《新药临床试验生物统计学指导原则》(征求意见稿)。该版本在一定范围内推广应用,为正式版本的发布积累了经验,也成为2002年12月1日起施行的《药品注册管理办法(试行)》的配套技术文件,为新药临床试验的统计学工作提供了方法学依据。
地位逐步提升
随着生物统计事业的推进,其学科地位也在与外界的交流中逐步明确。2003年1月18日,在CDE于北京举办的“新药临床研究生物统计学国际学术研讨会”上,美国FDA生物统计办公室主任Robert O’Neill首次与中国CDE线上交流时特别提及生物统计学在监管中的作用。
在经历广泛征求意见和试用后,2005年3月,原国家食品药品监督管理局正式发布《化学药物和生物制品临床试验的生物统计学技术指导原则》,明确强调了生物统计学方法在临床试验中的作用。
陈峰认为这一指导原则的发布,标志着中国临床试验生物统计学指导原则从无到有迈出了第一步,为后续体系建设奠定了基础。该原则在很大程度上借鉴了ICH E9的框架和理念,同时也结合了当时中国临床试验的实际情况做出了相应的调整。例如,当时尚无数据管理的相关指南,因此,该指导原则包含了试验数据管理的要求,包括记录、质量控制、内部审计等管理措施,尤其关注研究过程的规范性和文档管理。
法规形成体系
自第一部生物统计指导原则发布之后,我国在药品临床试验中不断积累经验。在此期间,在临床试验设计类型选择、比较类型确定、样本量估算、统计分析方法规范化应用等方面不断细化,逐步形成了一套既适合国内需求又独具特色的指导原则体系。
2010年底,CDE进行机构调整,成立了生物统计学审评部,也终于有了自己的统计审评员,现称统计与临床药理学部,目前统计学人员增加到约20人。
而在学术界,生物统计的发展也如火如荼。2011年,在中国卫生统计学会统计理论与方法专业委员会下成立了临床试验统计学工作小组(China Clinical Trial Statistics working group,CCTS),由药品审评中心内部和外部统计学审评专家,以及曾经在FDA工作过的统计学专家组成,并由陈峰担任组长。
CCTS在《中国卫生统计杂志》上陆续发表了5部专家共识,2018年出版了《临床试验统计学》专著;在全国范围内举办了大量的培训,以及临床试验统计学高级师资培训,提高统计学专业人员对临床试验生物统计学的认识和应用水平。
在数据管理方面,2013年中国临床试验数据管理工作小组(Clinical Data Management of China,CDMC)成立,由CDE的黄钦和第四军医大学(现空军军医大学)夏结来教授先后担任组长,成员由CDE统计部与外部统计学审评专家、企业界数据管理专家组成。2015年,CDMC专家在《中国药学学报》上以专辑形式发表了5部专家共识以及对其进行解读的19篇指导性论文;2020年出版了《临床试验数据管理学》专著,并在全国范围内举办了大量的培训,以提高企业研发人员、数据管理员对数据质量控制体系和标准的认识;在高校,还举办了专门的数据管理课程培训。

以此为基础,CDE在2016~2018年先后发布了一系列统计学与数据管理方面的指导原则,包括修订的《药物临床试验的生物统计学指导原则》,以及《药物临床试验数据管理与统计分析的计划和报告指导原则》《药物临床试验数据管理工作技术指南》《药物临床试验的电子数据采集技术指导原则》《生物等效性研究的统计学指导原则》等,对中国临床试验高质量数据管理起到了积极的推进作用。
特别是2016年修订的《药物临床试验的生物统计学指导原则》将“统计学技术指导原则”调整为“统计学指导原则”,删除“技术”一词。 这一变更,标志着业界对生物统计学的认知实现了质的跃升。生物统计学在临床试验中的角色,已从单纯的技术支撑工具,升级为贯穿试验设计、实施、分析及报告全流程的核心科学准则;且指南中的标题中删除了“化学药品和生物制品”,意味着中药临床试验也需遵循统一的科学标准。在内容上新增了适应性设计、独立数据监查委员会(IDMC)等相关内容,对中心效应、亚组分析、多重性等问题的处理策略和实践中的重点难点,提出了明确且具可操作性的要求。这一系列修订与完善,推动统计学在临床试验中的地位持续提升,作用也从传统的事后数据分析,向试验全流程的科学引领与风险把控不断深入。
2017年,国家药监局加入ICH。以此为契机,中国深入研究ICH各项原则,推动ICH在中国的采纳应用。生物统计学指导原则也进一步加速与国际进程。
2019年,CDE牵头成立生物统计学三方协调委员会,由监管方、学术方和企业方代表组成。该委员会撰写和发布了一系列统计学相关指导原则,内容涵盖随机化、盲法、协变量校正、亚组分析、多重性校正、样本量估计等方面;为了进一步鼓励创新,又出台了适应性设计、富集设计、真实世界研究等系列指导原则,确保中国在新药研发前沿领域与国际保持同步。截至目前,共有29部统计学、数据管理相关指导原则颁布实施或试行(见下表)。
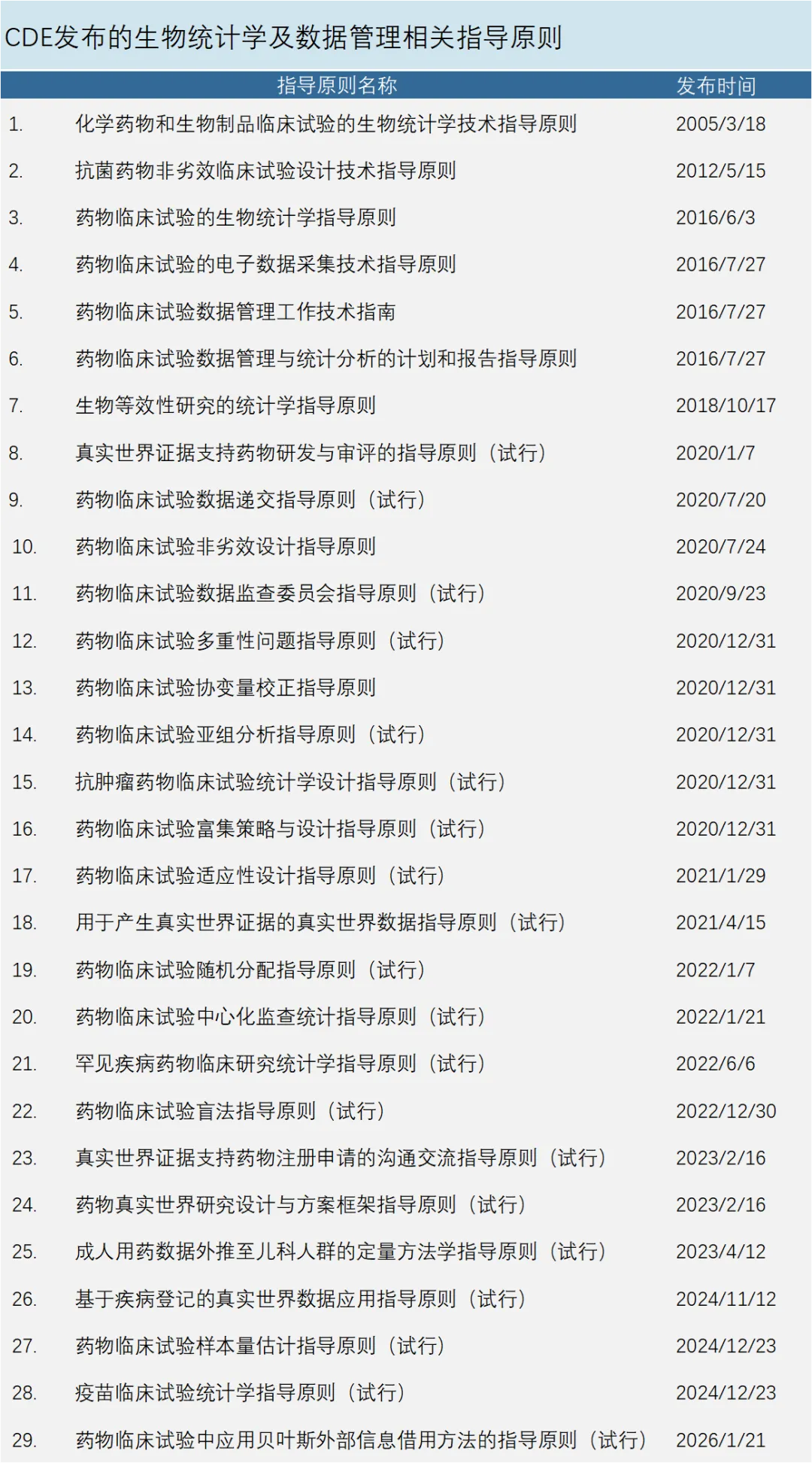
总结我国生物统计发展的关键历程,陈峰认为,生物统计学系列指导原则的实施,对药物临床试验和研究者发起的临床研究(IIT)的科学化、规范化开展,奠定了坚实的方法论基础,提供了系统全面的技术支撑;而更重要的是,系列指导原则的推行,对药物研发人员、临床试验工作者的统计学思维塑造、统计学设计理念的形成,产生了根本性的影响,极大地推动临床研究与生物统计学的深度融合;同时,指导原则的实施亦对生物统计学科本身的发展也产生了积极影响,其在实施中培养了一批具备扎实统计学知识和丰富实践经验的专业人才,分布在药企、医疗机构、高校与科研院所、CRO和药品监管部门,使得统计学在临床研究中发挥巨大作用。
砥砺前行
尽管中国在药品临床试验统计学领域取得成就,但陈峰认为仍面临一些挑战。
首先,陈峰认为,临床试验的创新能力有待提升,尤其在机器学习、AI等新兴技术与统计学的融合应用上,要加强跨学科合作,探索利用AI优化试验设计、强化质量控制、加速试验进程、提高数据分析效率。在大数据、AI等技术迅猛发展的当下,有人抛出“统计学无用论”,认为统计学在临床试验中的作用将被削弱或取代。“然而事实恰恰相反,”陈峰认为,AI的底层逻辑正是统计学,统计学与AI的融合,为临床试验的科学性、可靠性和有效性提供了保障。贝叶斯统计的决策思维和方法也必将逐步被应用,并推动创新临床研究的发展。
其次,信息安全与共享面临挑战。要建立完善的相关法律法规和统一的标准化体系,完善科研评价机制,构建高效数据管理和共享平台,确保数据安全、准确及高效利用。
无论是药械研发亦或是IIT,陈峰呼吁都要坚守科学研究的底线,始终以患者为中心开展临床试验工作。统计学方法的创新,虽然能增强设计灵活性、提升研究效率、借用既往信息、减少样本量等,但应充分认识到创新设计的潜在风险,必须在严谨的科学论证、严格的风险把控、规范的监管框架下实施,杜绝滥用,更不能成为个别企业在研发过程中投机取巧、逾越科学底线的便利通道。
经过三十年的积淀与发展,我国生物统计学专业已经取得明显进步。在人才培养方面,自2003年南京医科大学在全国率先招收生物统计专业方向本科生以来,已有十几所高校陆续开设了生物统计本科专业,70余家高校开展了相关方向的研究生培养,硕士和博士研究生的培养规模也在稳步发展。部分高校在临床医学专业开设临床试验设计、实施与分析等相关选修课程;有关学术组织通过举办高级研修班、专题培训班,加强在职人员的继续教育。
但即便如此,与行业高质量快速发展对高端专业人才的迫切需求相比,我国生物统计专业领域创新复合型人才依然供不应求。鉴于此,陈峰倡导和鼓励青年学子继续深造,通过系统的高阶教育提升自身的综合学术素养与实践能力。在他的影响下,许多青年学者已经成长为高校人才培养、医院临床研究、企业产品研发等专业领域的中坚力量,部分优秀中青年专家已经成为国家药品审评专家。而他所秉持的专业理念与学术追求,也在这一代代传承中,不断焕发新的生机。

 产业资讯
产业资讯
 新华网
新华网  2026-02-13
2026-02-13
 572
572

 产业资讯
产业资讯
 会会药咖
会会药咖  2026-02-13
2026-02-13
 521
521

 产业资讯
产业资讯
 识林
识林  2026-02-13
2026-02-13
 520
520