 产业资讯
产业资讯
 2015-01-21
2015-01-21
 3071
3071
来源:新康界 2015-1-21
以CDE为代表的审批机构,真的就是我们所说的那么不作为么?
还有一个多月,也就是农历的新年,在各种传言和各种公开和非公开的文件的传言和执行或者默认执行中,药品研发和注册人员,立项人员,以及传说中的BD人员,在或有或无的业绩中,毫无悬念的渡过了2014年。在过去的一年里,广大一线员工受尽折磨,企业高层领导也无所适从。现就现有一些数据和传闻,对咱这行业做一个简单的预测或者说瞎掰。
在很多qq群,微信群,自媒体,甚至是纸质媒体,隔三岔五的就有各种大牛各个精通excel的从业人员,在各种公开和非公开的数据“分析”之后,洋洋洒洒的文章遍地开花,从来没有人记得在7年多前,自己或多或少的参与抨击sfda过度“放松”的政策,而是在统计学都没有入门的情况下,在各种小样本数据的基础上,对CDE和CFDA进行各种预测,那么,以CDE为代表的审批机构,真的就是我们所说的那么不作为么?
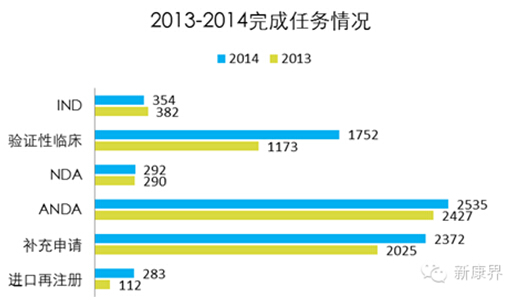
数据显示,2013-2014,CDE所承办的任务,总数变化不大。
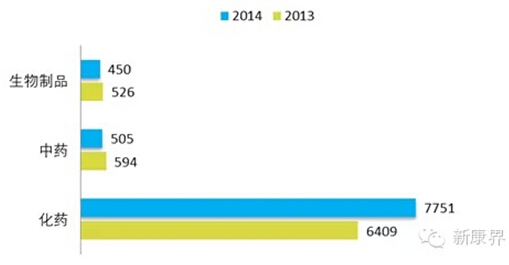
其中化学药品各个任务:
从2007年起,CFDA在顶着前几年的审批原则过于宽松的情况下,在各项文件情况下,有兴趣的同学们,可以得出自从2007年起审批逐年降低的结论。按照CDE在按照劳动编制标准,审评老师有限的情况下,完成任务,其实却是很拼的。上图唯一值得解释的数据就是验证性临床的承办任务大幅度上升,毕竟,所有的申请人还是趋利的,选择能变现或者说能看到希望的3.1类, 企业,包括研发人员的我等,看到几千位的排队ANDA任务,心理都会掂量自己在现在老板的公司能不能看到当年自己申报的品种。
值得注意的是,自从2009年以来,进口再注册转CDE审评的情况越来越多,化药部分:
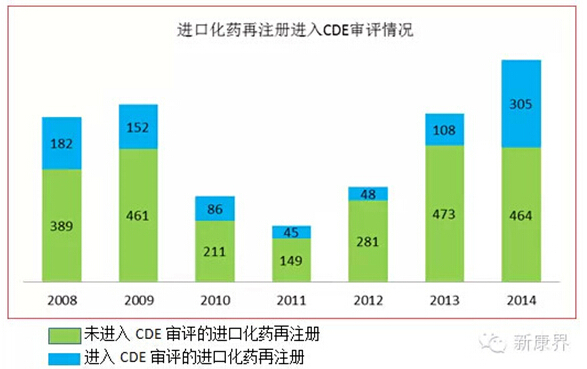
生物制品部分数据因数据量较小未做统计。2009年《关于进口药品再注册有关事项的公告》出台,明确转CDE审评的情况 。由于欧盟和美国的部分药学变更只需要告知备案或在年报中说明即可,而目前我国的法规在一些细节上还没有完全与欧美接轨,因此在再注册提交的资料后发生一些变更而转入CDE的审评情况,是不可避免的。
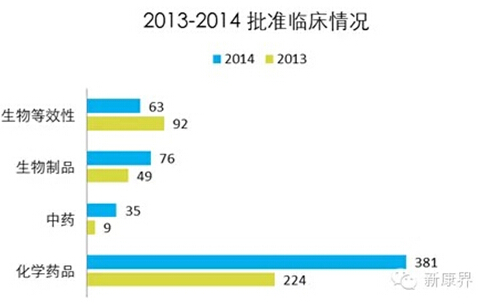
备注:生物等效性数据判断为在ANDA序列中批准临床的化药部分(含5类)
由上面结果可以知道,CDE的审评资源在向创新药(3.1,1.1)倾斜,尽管在2013年度CDE的审评报告里,似乎传说中有一个2013-2014年专利到期名单,这个名单会优先审评,而数据告诉我们,2014年优先审评出来的临床,还是以创新药为主。6类排队越积累越长。
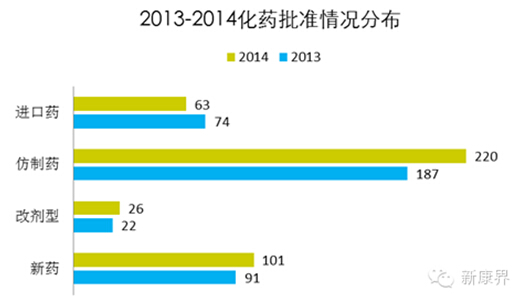
中药方面,在2007年《药品注册管理办法》颁布施行之后,对中药改剂型和防止几乎彻底关门(关于中药的详细申请数据和政策解析另文描述),2007年10月1日~2014年,CDE承办的一些中药申请数据如下:
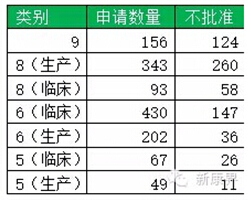
药品审核查验中心(原认证管理中心)生产现场检查完成情况(以受理号计算):
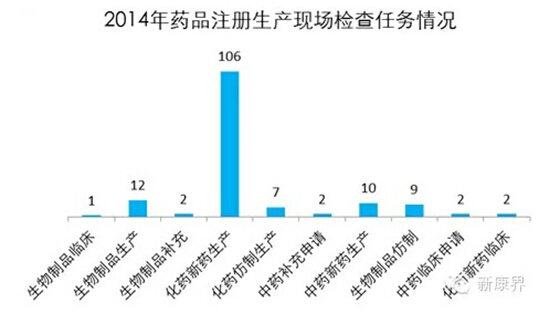
按照每个产品2-3天的检查时间,CCD的负责检查老师们估计也是不在现场检查,就在生产检查的路上,也是蛮忙的,蛮拼的。
回顾2013-2014年,在有限的审评资源的情况下,CDE还是完成了与2013年相当任务量的申请审评,但研发机构已经是迫不及待,申请量还在上涨,化药3类任务的积压也在逐年上升,仿制药的审评排队已经逼近8000,有研发人员调侃,口服6类来两个排队,批准上市之日,研发人员很有可能退休了。
而针对“争取在2016年消化存量,2017年实现注册申请和审评数量年度进出平衡,2018年按照时限要求完成审批”的这个建议,药审中心一方面在招兵买马,一部分审评审批权限下放省局,增加效率。为集中解决积压的注册申请,CDE还效仿了FDA的做法。
于是,在2014年年底,CDE组织了省局进行了一次关于立卷审查的培训。消息最早从网络上传播,随后有省局已经默认这个消息的存在。笔者也在第一时间学习了这个文件,按照文件的指导精神,这个可能性是存在的。确实有一很大批注册申请不能达到立卷审查的要求,至于这些申请是退审,发补,还是集中审评?有待考证。

 产业资讯
产业资讯
 药创新
药创新  2025-05-14
2025-05-14
 38
38

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-05-14
2025-05-14
 35
35

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-05-14
2025-05-14
 39
39