 产业资讯
产业资讯
 2014-03-26
2014-03-26
 3174
3174
来源:慧聪制药工业网 2014-3-26
近日,国家卫生计生委办公厅、总后卫生部科训局发出通知,启动重大新药创制科技重大专项2015年度课题申报工作。2015年度课题将开展具有重要临床价值的创新药物研究;瞄准国际技术前沿,开展有助于解决瓶颈性问题的关键技术和具有战略作用的培育性技术研究。
品种研发课题涉及多个领域
据了解,在品种研发上,新增课题重点针对恶性肿瘤、心脑血管疾病、神经退行性疾病、精神性疾病、糖尿病、自身免疫性疾病、耐药性病原菌感染、肺结核、重大病毒感染性疾病以及其他常见病和多发病(呼吸系统和消化系统疾病等)等10类(种)重大疾病开展研究。
中药类重点支持开展临床优势突出的创新中药临床研究(近3年内获得临床试验批件,并已开展临床研究)。
生物药领域重点支持新结构抗体、双特异抗体、抗体偶联药物,全新结构蛋白及多肽药物,生物类似药;具备新技术、新工艺制备新型疫苗,联合疫苗及治疗疫苗等,具备较好成药性研究基础的创新品种。
我国创新药市场薄弱
近年来,我国对创新药品的发展十分关注,创新药因为价格低廉、有利于看病难、看病贵而备受重视。,然而目前我国生产的药品,多以仿制为主,自主创新犹如凤毛麟角,创新药市场发展仍旧薄弱。
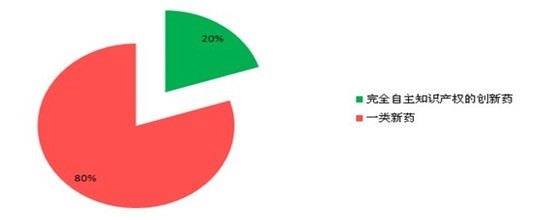
我国多种领域创新药物缺乏,记者查阅资料发现,国家一类新药仅20种左右。专家介绍,我国真正意义上的有完全自主知识产权的创新药,不超过5种。
重大新药创制启动给创新药带来无限发展空间
虽然我国创新药市场发展缓慢,但近来药企接连传出和消息:恒瑞医药两大重磅新药——甲磺酸阿帕替尼和长效G-CSF审评进度推进,在药品审评中心的状态均由“排队待审评”转为“正在审评中”;贵州百灵1.1类创新药获批,乙肝用药市场超3千亿;胰岛素国内巨头通化东宝旗下数个1.1类生物类似物也处于研发阶段……
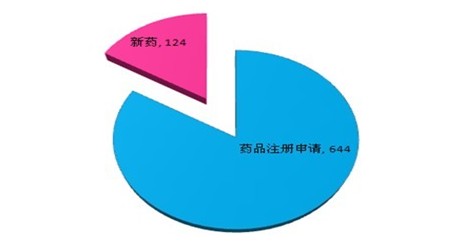
据一份资料显示(据调查):2011年,SFDA共批准境内药品注册申请644件,其中新药124件,占到了19%。批准的新药比例同比上升6个百分点。其中1.1类化学药品共批准10件,相比2009年及2010年都有显著增长。
全国人大常委会副委员长桑国卫院士多次在公开场合表示。“未来5~10年,我国新药创制将取得重大成就。”
重大新药创制启动课题多家药企将受用。涉及化药企业包括华北制药、海正药业等;生物药方向涉及企业包括沃森生物、白云山、海欣股份、中源协和、上海莱士等;中药方向则涉及同仁堂、天士力、以岭药业等。药企不仅获得科研经费支持,在新药注册审批上也享有优先审批的待遇,有专设的快速通道保障新药的审批效率。这为我国创新药的发展提供了无限的发展空间。
 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 104
104

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 93
93

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 81
81