 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻  2022-12-19
2022-12-19
 3567
3567
2022年12月12日,Mirati Therapeutics(以下简称“Mirati”)宣布FDA已加速批准KRAZATI(adagrasib),作为具有KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的靶向治疗选择。KRAZATI是全球第2款获批的口服KRAS抑制剂。

关于KRAZATI
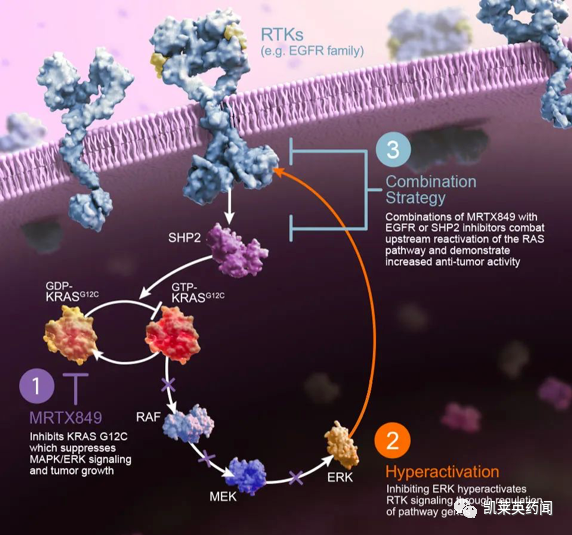
KRAZATI是一种高选择性和强效的 KRAS G12C口服小分子抑制剂, 经过优化以维持靶点抑制;由于 KRAS G12C 蛋白每 24-48 小时再生一次,这一属性对于治疗 KRAS G12C突变的癌症十分重要。KRAZATI将继续作为单一疗法,并与其他抗癌疗法联合用于晚期 KRAS G12C突变实体瘤患者,包括非小细胞肺癌、结直肠癌和胰腺癌。2021年6月,再鼎医药预付6500万美元、总价3.38亿美元获adagrasib (MRTX849)引入大中华区(中国大陆、香港、澳门和台湾地区)独家权益,目前已向中国国家药监局药品审评中心(CDE)提交的adagrasib(阿达格拉西)临床试验申请。
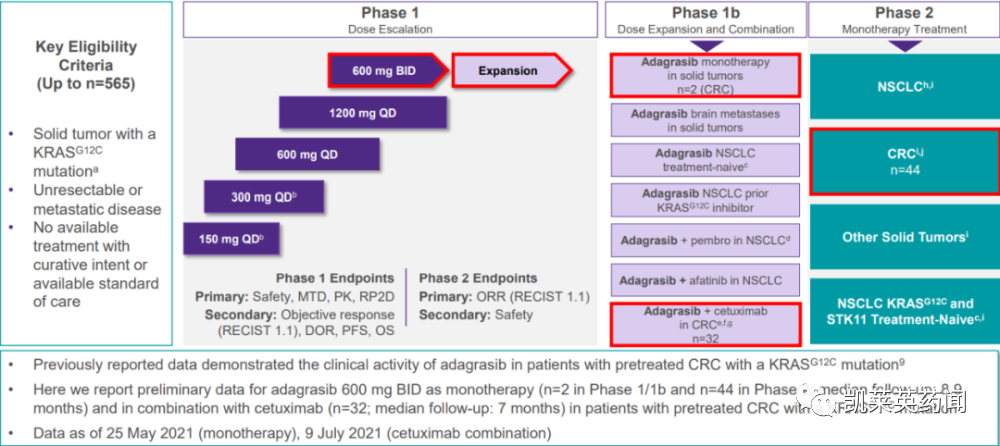
该药物在FDA的加速获批是基于2期KRYSTAL-1注册研究的数据,在116名早前接受过铂类方案和免疫检查点抑制剂的治疗的KRASG12C突变晚期NSCLC患者中,给予600mg KRAZATI胶囊每天两次口服,根据实体瘤反应评估标准(RECIST v1.1),通过盲法独立中心评价(BICR)评估,确认患者的客观缓解率(ORR) 和缓解持续时间 (DOR)。结果显示:ORR 为 43% (95% CI:34-53),80% (95% CI:71-87) 的患者实现了疾病控制。中位DOR为8.5个月(95%CI:6.2-13.8)。
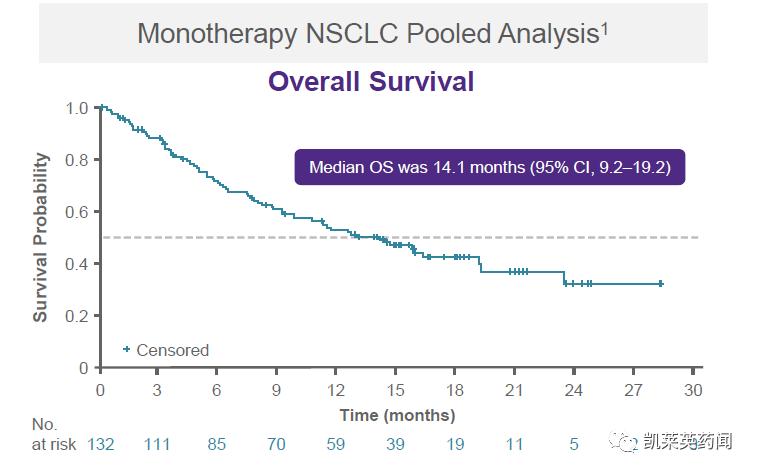
此外,在包括来自KRYSTAL-1研究的1/1b期NSCLC和注册2期NSCLC队列的汇总疗效分析(n=132)中,评估adagrasib单药每日口服2次治疗的效果,结果显示:ORR为44%,疾病控制率为81%,中位DOR为12.5个月(95%CI, 7.3-NE),中位总生存期为14.1个月(94%CI,9.2-19.2)。
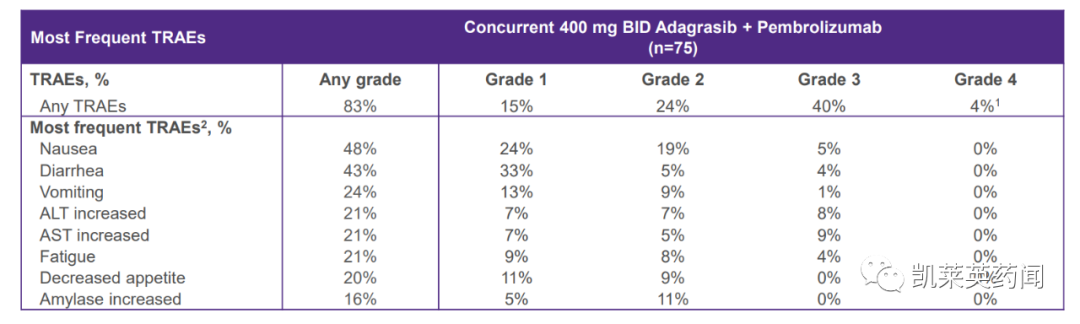
在不良反应上,在 366 名参加 KRYSTAL-1 和 KRYSTAL-12 的患者中,最常见的(≥25%)不良反应是恶心、腹泻、呕吐、疲劳、肌肉骨骼疼痛、肝毒性、肾功能损害、水肿、呼吸困难和食欲下降。由于不良反应,KRAZATI的永久性停药发生在13%的患者中。
关于KRAS
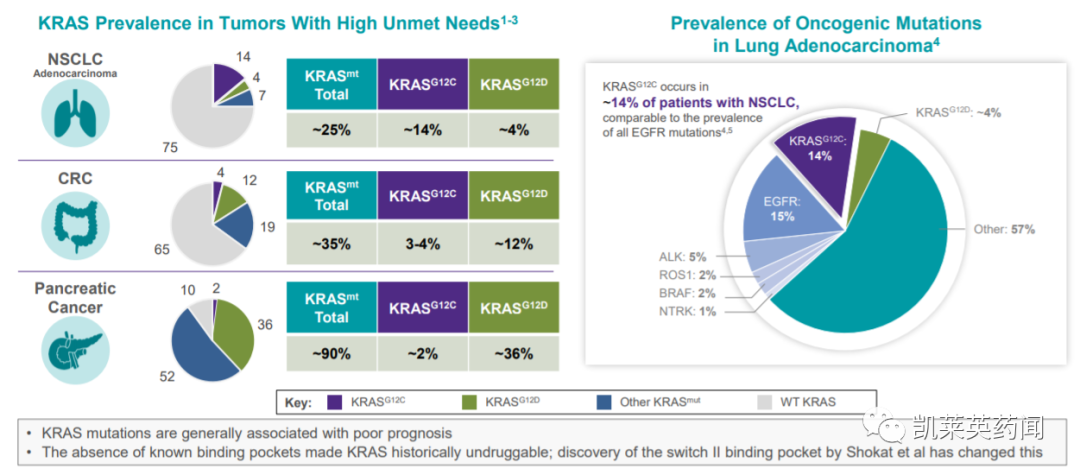
由于KRAS突变体的结构特点、信号通路的复杂性以及KRAS突变型肿瘤的耐药性,KRAS一度被称为“不可成药靶点”。其中,KRAS G12C作为一种特定的KRAS亚突变,是第12个密码子的甘氨酸被半胱氨酸取代,约占所有KRAS突变的44%,其中非小细胞肺癌腺癌中最常见,占14%,其次是大肠腺癌占3-4%,胰腺癌占2%,全球每年超过100000人确诊为KRAS G12C突变。
随着KRAS抑制剂研究不断取得新进展,近年来越来越多的企业开始布局KRAS抑制剂领域,探索新的组合疗法, 下表是有关KRAS近年来的交易情况:

除KRAZATI外,目前全球上市的另一款KRAS抑制剂是安进的 Lumakras(sotorasib)。根据Fierce Pharma预测, 2025年的sotorasib预测市场为13亿美元,而adagrasib在2026年预测市场可达17亿美元。将全球处于临床以上阶段的KRAS药物统计如下:

关于Mirati
Mirati是一家处于临床阶段的生物技术公司,其使命是发现,设计和提供突破性疗法,以改变癌症患者及其亲人的生活。公司坚持不懈地致力于推出解决包括肺癌在内的高度未满足需求的领域的疗法,并推进针对癌症遗传和免疫驱动因素的新型疗法的管线。

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 96
96

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 98
98
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 100
100