 研发追踪
研发追踪
 迈极康insight
迈极康insight  2023-01-13
2023-01-13
 5209
5209
1月11日,阿斯利康(AstraZeneca)和Avillion共同宣布,其联合开发的Airsupra(沙丁胺醇/布地奈德,PT027)已获得美国FDA批准,用于按需治疗或预防支气管收缩,并降低18岁及以上哮喘患者恶化的风险。新闻指出,Airsupra(沙丁胺醇/布地奈德,PT027)是首个也是唯一一个在美国批准用于按需治疗以降低哮喘恶化风险的急救药物。
哮喘是一种慢性、炎症性呼吸道疾病,症状多样,影响全球多达2.62亿人。哮喘患者会反复出现呼吸困难和喘息,症状会随时间、严重程度和频率而变化。这些患者无论其疾病严重程度、是否坚持治疗或控制水平如何,都有严重恶化的风险。据估计,全球每年有1.36亿例哮喘发作,其中美国超过1000万例;这些对许多患者来说是身体上的威胁和情感上的重大影响,并且可能是致命的。
Airsupra是阿斯利康和Avillion联合开发的一种“first-in-class”的加压定量吸入器(pMDI)固定剂量组合救援药物,含有沙丁胺醇、一种短效β2激动剂(SABA)和布地奈德,一种抗炎吸入皮质类固醇(ICS)。
此次FDA的批准是基于MANDALA和DENALI 3期试验的结果。MANDALA是一项3期、随机、双盲、多中心、平行组、事件驱动试验,旨在评估Airsupra与沙丁胺醇在3132名中度至重度哮喘患者(4-11岁)首次严重哮喘加重时间上的疗效和安全性,这些哮喘患者单独服用ICS或联合一系列哮喘维持疗法。试验结果显示,与沙丁胺醇相比,Airsupra在中度至重度哮喘患者中显着降低了严重恶化的风险。与沙丁胺醇相比,Airsupra在180mcg沙丁胺醇/160mcg布地奈德剂量下将成人和青少年严重恶化的风险降低了27%(p<0.001),严重哮喘发作风险显著降低26%。MANDALA试验的相关结果已于2022年5月发表在《新英格兰医学杂志》上。
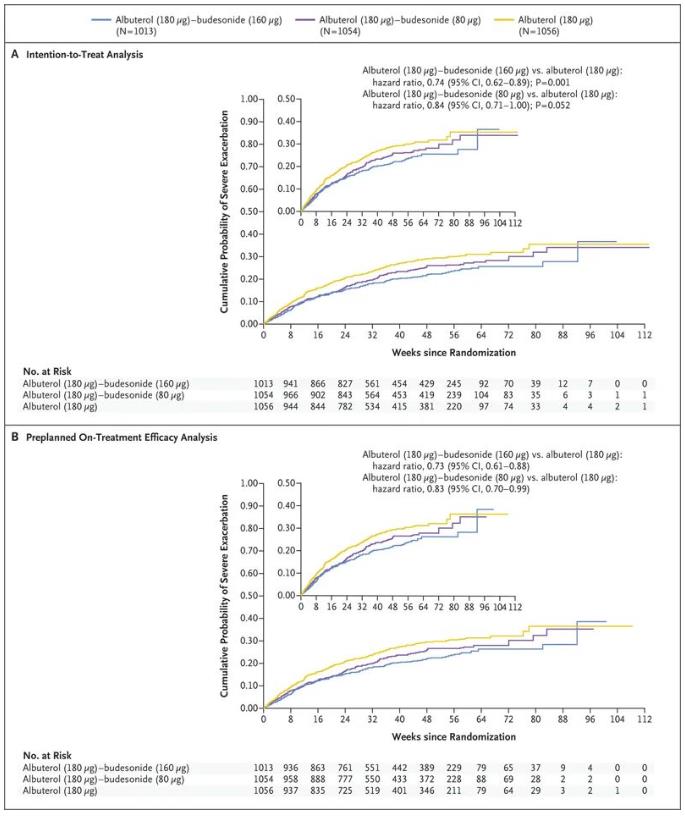
另一项3期DENALI随机、双盲、安慰剂对照、多中心、平行组试验,旨在评估Airsupra与其成分沙丁胺醇和布地奈德相比对改善1001名成人、青少年及4-11岁儿童肺功能的疗效和安全性。试验结果显示,与沙丁胺醇和布地奈德的单独成分或与安慰剂相比,Airsupra在12岁或12岁以上的轻中度哮喘患者中,通过一秒钟用力呼气量(FEV1)测量的肺功能有统计学上的显著改善。
两项试验中Airsupra的安全性和耐受性与已知成分的情况一致,最常见的不良事件包括头痛、口腔念珠菌病、咳嗽和发音困难。
阿斯利康生物制药研发执行副总裁Mene Pangalos说:“在美国,每年有超过1000万的患者经历哮喘加重,而不受控制的哮喘预计将在未来20年给美国经济造成数十亿美元的直接医疗费用,今天的积极决定对占美国哮喘患者80%以上的成年人哮喘患者来说是个好消息。医生将能够为他们的患者提供Airsupra,这是一种重要的新型救援疗法,可以降低哮喘恶化的风险。”

 研发追踪
研发追踪
 医道社创新药新前沿
医道社创新药新前沿  2026-03-02
2026-03-02
 127
127

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2026-03-02
2026-03-02
 127
127

 研发追踪
研发追踪
 药渡
药渡  2026-03-02
2026-03-02
 133
133