 医改专题
医改专题
 中国医疗保险
中国医疗保险  2023-01-17
2023-01-17
 3195
3195
近日国家卫健委发布的《新型冠状病毒感染诊疗方案(试行第十版)》中已列出多种小分子抗新冠病毒药物、单抗、中成药和中药剂处方。在国外研究较多的有帕克洛维(Paxlovid)、莫诺那韦胶囊(molnupiravir)、 氟伏沙明 (Fluvoxamine),在单抗方面有REGEN-COV、Sotrovimab。而在国内研究的创新药物多为阿兹夫定、安巴韦单抗/罗米司韦单抗等。
Paxlovid是由“奈玛特韦(150mg)/利托那韦片(100mg) ”组合包装的口服片剂。每日服用两次,用于治疗发病5天内的成人,伴有进展为重症高风险因素的轻至中度新型冠状病毒感染患者。高危因素为伴有高龄、肥胖、慢性肾脏疾病、糖尿病、心血管疾病、慢阻肺病等重症高风险危险因素的患者。2021年12月被美国FDA批准后,已在不少国家相继紧急批准用于高风险的新冠病毒感染者。莫诺那韦也是发病5天内口服治疗,每次800毫克,每12小时服用一次,共服5天。
Paxlovid具有明确的三期临床试验证据,证明具有明显的临床疗效。但根据2021年加拿大CADTH提出的药物实施建议(Drug implementation advice)报告,在肯定其临床疗效的基础上,也指出该药研究缺乏成本和药物经济学的评价结果。本文撰写的目的是为了提高今后开展小分子抗新冠病毒药物的药物经济学评价研究水平,现将国际上已有的文献依据做一概述,为我国未来抗新冠病毒药物的创新临床研究和定价提供循证的依据。
一、如何开展抗新冠病毒药物的科学临床试验?
首先需要指出的无论是Paxlovid还是莫诺那韦都是美国FDA根据已有的临床试验结果授权紧急使用的(emergency use authorization, 简称EUA)。说明其疗效还有待于上市后的真实世界研究进一步肯定其疗效。
抗新冠病毒感染药物的评价与其他药物一样必须遵循PICO原则,(1)P是指研究的对象和人群(population)。以Paxlovid 的临床三期EPIC-HR试验为例,干预组和对照组分别为1036和1049例,两组患者均在千例以上。其次将患者采用梯度风险分组的方法(tiered risk group approach),按照有无免疫缺陷疾病、未接种疫苗者的年龄分组分成60岁、70岁或80岁以上)、居住地区、有无在护理医院住院、伴随疾病的种类等因素将患者分成三个梯度等级。(2)I是指干预措施(intervention)。这里是指使用那种小分子抗新冠病毒药物。(3)C是指参照物(comparator), Paxlovid 的三期临床试验(EPIC-HR)和莫诺那韦的三期临床试验(MOVe-OUT)的对照组均采用常规治疗(usual care)为安慰剂对照组。(4) O是指研究的结果(outcome),治疗的疗效指标采用由任何原因引起的住院或死亡的百分比(%),病死率(%)和进入ICU病房的比例(%)。还有其他因素,包括分析病人是否来源于医院门急诊患者(setting),观察时间是从感染发病5天内直止发病28天后(time horizon),所以将临床试验设计从PICO原则进一步扩大到PICOST原则。
在评价临床疗效时采用的是改良意向性分析方法(modified intent-to-treat,简称mITT)。也就是将患者按随机分配来分析,也允许患者拒绝分配,不管患者最后是否真正接受Paxlovid 治疗方案,这就是意向性治疗的原则。第一次分析是选所有患者均在发病3日内治疗的样本数,第二次分析则扩大到所有患者均在发病5天内的治疗样本数。临床试验最后的结果见表1。
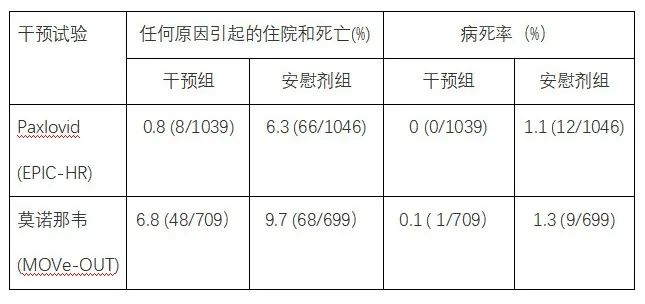
表1 不同抗新冠病毒小分子药物三期临床试验的效果比较
III期临床试验结果显示两组基线情况是一致的,包括年龄组、性别、地域、体重指数、发生症状天数、伴随疾病风险、抗体水平和既往单克隆治疗情况均没有统计学上的差异。87%患者年龄在18-65岁之间,美国患者占41%,欧洲患者占30%。所有患者均无疫苗接种史,但51%病人新冠病毒抗体测定已为阳性。试验时期主要新冠病毒的流行毒株为Delta型21J、21A和21I。Paxlovid 和莫诺那韦对任何原因引起的住院和死亡率分别能降低88%和30%,疗效均优于对照组。
二、如何进行安全性的比较研究?
鉴于不同小分子抗新冠病毒药物的药理性质和靶点不同。Paxlovid 是属于3CL蛋白酶抑制剂 (protease inhibitor),破坏新冠病毒复制过程。莫诺拉韦属于RNA聚合酶(RdRp)抑制剂,通过阻断新冠病毒RNA依赖的RNA聚合酶合成。Paxlovid中含有利托那韦成分,后者具有延缓奈玛特韦在肝脏中的分解代谢作用,因此,也造成了更多的药物与药物之间的副反应发生,对有肝肾功能不全的病人禁用。
在Paxlovid的EPIC-HR临床试验中2246例随机分配的病人中有94%患者完成了安全性随访观察直止开始治疗后的34天。不可否认Paxlovid和莫诺拉韦对患者均有较好耐受性。但莫诺拉韦在实验室中证明具有对生长的骨骼和软骨具有致突变、致畸和毒性作用。美国FDA考虑由于5天的短程疗法只有低度的风险,因此授予紧急使用权,可在没有其他有效治疗抗新冠病毒药物时使用,但不能在孕妇和母乳喂养的妇女中使用。
Paxlovid三期临床试验显示发生副反应率(AE%)在试验组和对照组分别为22.6%和23.9%,两组无显著差别。但Paxlovid组发生的味觉障碍和腹泻较对照安慰组高,分别为5.6%和3.1%。
三、如何克服临床研究设计中的缺陷?
Paxlovid的EPIC-HR试验是一个多中心的、三期临床随机对照双盲试验,治疗对象均为轻型和中度型患者具有转归成重型患者的风险人群,主要是成人门诊病例,年龄在18岁以上,总研究人数为2246例。莫诺拉韦的MOVe-OUT 三期临床试验总研究人数为1433例。由于实验患者均为未接种新冠疫苗,以前也没有接受过单克隆抗体治疗。由此可见,如果试验对象均已接种过新冠疫苗的话,临床的治疗效果就可能并没有像文献报告的那样好。其次,EPIC-HR临床试验研究阶段主要是Delta毒株,还没有Omicron变异毒株的流行,因此不同亚型的毒株是否均有相同的治疗效果也是值得进一步研究的。
总之,现有的三期临床试验效果还存在很大的临床疗效不确定性,一是随着新冠病毒的快速进化,免疫逃逸的现象十分明显,可能导致不同毒株和不同地区的感染发病率和死亡率的变化。二是这些三期临床试验招募的对象都是没有接种过新冠疫苗的患者,健康状况要比一般人群好。三是住院率和卫生资源的利用在不同国家和地区存在很大的差异,特别是当Omicron毒株流行的情况下,更是难以估计,这些研究的局限性必须予以考虑。此外,Omicron毒株引起的轻度和中度的患者要比Delta毒株感染后引起的比例要多,可能会获得更低的成本效果。
四、如何开展药物经济学的评价研究?
根据美国临床和经济评价研究所(Institution of Clinical and Economic Review, 简称ICER)的报告Paxlovid的药物经济学研究结果主要是采用Markov模型法。病人主要来自于门诊和急诊病人,模型仅分成存活和死亡两个阶段。基线调查结果见表2。从各种效用值来看,新冠小分子药物获得QALY和LY的改善与常规治疗组来比,改善是非常有限的。
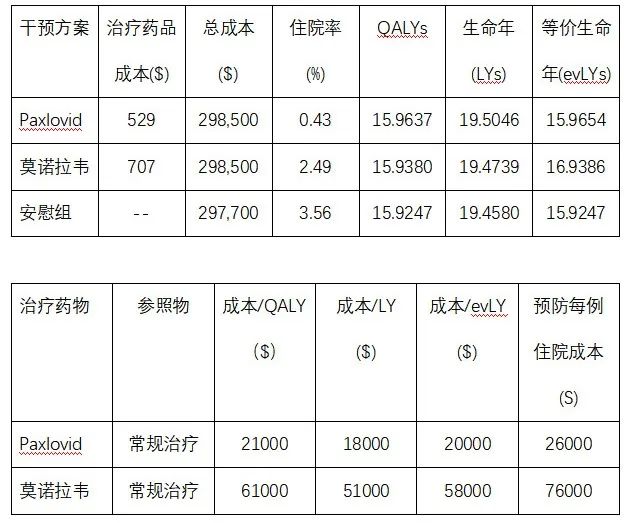
表2 Paxlovid 和莫诺拉韦增量成本效果的评价
对不同阈值下的QALY值还进行了概率敏感度分析(PSA),显示按美国标准每QALY阈值在$50,000、$100,000和 $150,000三种阈值条件下计算概率分布,Paxlovid的效果优于莫诺拉韦,前者分别为97%,100%,100%,而后者仅为31%,69%和84%。
在抗新冠病毒药物定价方面,美国ICER机构采用健康效益为价格基准的方法(health benefit price benchmarks),推测Paxlovid和莫诺拉韦在美国不同阈值情况下的价格制定标准。不同阈值条件下的药品价格呈现很大的差异。
鉴于这两类药品与常用治疗方法在三期临床试验中的增量成本和增量存活的效益均非常接近,因此,ICER机构并没有开展预算影响的分析。
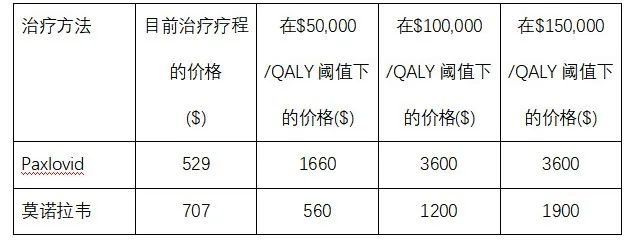
表3 Paxlovid 和莫诺拉韦按健康效益为价格基准的定价比较
有意思的是在上述研究中,美国Paxlovid的定价明显比莫诺拉韦要低。Paxlovid疗程价格定为529美元,而莫诺拉韦的价格定为707美元,但在不同阈值下总费用要比Paxlovid便宜。在中国目前情况下,尽管Paxlovid没有医保谈判成功,即使它的挂网价格已降为每盒人民币1890元,还是要比现有进口的莫诺拉韦定价每盒1500元要贵。
由于上述药品在各国的比价并不相同,能否利用表2列举的三期临床试验获得的QALY、LY、evLY数值,再结果目前在中国的总治疗费用,药品疗程费用重新计算增量成本效果的比值(ICER),从而估算Paxlovid和莫诺拉韦的基准价格是今后值得研究的方向。

 医改专题
医改专题
 医药云端工作室
医药云端工作室  2025-12-27
2025-12-27
 78
78

 医改专题
医改专题
 医药云端工作室
医药云端工作室  2025-12-26
2025-12-26
 130
130

 医改专题
医改专题
 E药经理人
E药经理人  2025-12-25
2025-12-25
 195
195