 会员动态
会员动态
 医药观澜
医药观澜  2023-02-01
2023-02-01
 3760
3760
今日(1月31日),中国国家药品监督管理局(NMPA)官网最新公示,恒瑞医药抗PD-1单抗注射用卡瑞利珠单抗新适应症上市申请已获得批准。公开资料显示,这是卡瑞利珠单抗在中国获批的第9项适应症。
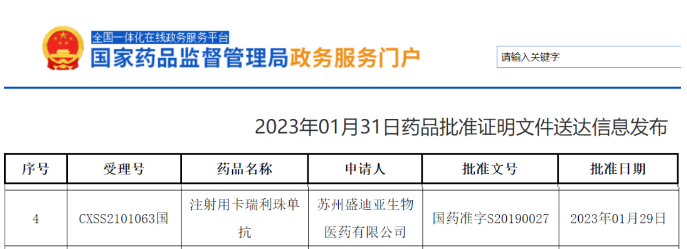
截图来源:NMPA官网
卡瑞利珠单抗是恒瑞医药研发的一款人源化PD-1单克隆抗体,可与PD-1受体结合,并阻断PD-1/PD-L1通路,激活T细胞,对肿瘤细胞产生免疫杀伤作用。根据恒瑞医药公开资料,卡瑞利珠单抗自2019年5月首次在中国获批以来,目前已经在中国获批8项适应症,涉及经典型霍奇金淋巴瘤、晚期肝细胞癌、非鳞状非小细胞肺癌(NSCLC)、鳞状NSCLC、食管鳞癌、鼻咽癌等不同的肿瘤。
2022年5月,恒瑞医药宣布卡瑞利珠单抗联合甲磺酸阿帕替尼(“双艾”方案)用于既往未接受过系统治疗的不可切除或转移性肝细胞癌患者的一线治疗的上市许可申请已获得NMPA受理。其中,阿帕替尼是恒瑞医药开发的一款针对血管内皮生长因子受体(VEGFR)的小分子酪氨酸激酶抑制剂,已经在中国获批治疗期胃腺癌或胃-食管结合部腺癌、肝细胞癌等适应症。
早先,双艾方案的国际多中心3期临床试验(SHR-1210-Ⅲ-310)由独立数据监察委员会(IDMC)判定主要研究终点结果达到方案预设的优效标准。这是一项随机对照、开放性、国际多中心3期临床研究,评估卡瑞利珠单抗联合阿帕替尼对比索拉非尼治疗既往未接受过系统治疗的不可切除或转移性肝细胞癌患者有效性和安全性。该研究由南京金陵医院肿瘤中心秦叔逵教授担任全球主要研究者,在全球13个国家和地区的95家中心进行。
该3期临床研究结果表明,卡瑞利珠单抗联合阿帕替尼对比索拉非尼作为一线治疗可以显著延长晚期肝细胞癌患者的无进展生存期和总生存期。据悉,SHR-1210-Ⅲ-310研究也是恒瑞医药推进开展的首个国际多中心3期临床研究。基于此研究,卡瑞利珠单抗治疗晚期肝细胞癌适应症还获得了FDA授予的孤儿药资格。
目前,恒瑞医药还在探索卡瑞利珠单抗在更多适应症中的治疗效果。根据中国药物临床试验登记与信息公示平台,卡瑞利珠单抗共有近30项临床研究正在进行中,其中包括多个3期临床研究。除了已经获批的适应症之外,这些3期临床研究针对的适应症还包括:
经肝动脉化疗栓塞术(TACE)联合卡瑞利珠单抗和阿帕替尼治疗肝细胞癌;
联合研究者选择的化疗方案治疗既往复发转移阶段至少接受过二线化疗方案的转移性三阴性乳腺癌;
联合化疗新辅助治疗三阴性乳腺癌;
联合多靶点酪氨酸激酶抑制剂法米替尼治疗既往含铂类化疗和免疫检查点抑制剂治疗失败的晚期NSCLC;
联合法米替尼对比帕博利珠单抗一线治疗PD-L1表达阳性的复发性或转移性NSCLC;
联合或不联合阿帕替尼治疗复发/转移阶段未经系统性治疗的PD-L1表达阳性的NSCLC;
联合法米替尼治疗复发转移性宫颈癌;
联合阿帕替尼用于肝细胞癌根治性手术或消融后伴高复发风险人群辅助治疗;
联合阿帕替尼治疗晚期胃癌等等。
希望卡瑞利珠单抗的其它适应症临床研究也顺利进行,并在中国早日获批,造福更多患者。
参考资料:
[1]2023年01月31日药品批准证明文件送达信息发布 . Retrieved Jan 31 , 2023. from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20230131141048130.html
[2] 国际化再进一步!恒瑞医药“双艾”方案国际多中心III期临床研究达到主要研究终点. Retrieved May 12 , 2022. From https://mp.weixin.qq.com/s/Iy6gJ-U-Rii5wQpFhl0TCw
[3] 获批适应症总数达8个!恒瑞医药卡瑞利珠单抗又增两个新适应症. Retrieved Dec 13 , 2021. From https://mp.weixin.qq.com/s/puP1npoNBqdqwfPPXQ7-uQ
[4] 里程碑!恒瑞医药卡瑞利珠单抗全球首个一线鼻咽癌适应症获批. Retrieved Jun 10 , 2021. From https://mp.weixin.qq.com/s/FNxBK3tub8Hc2-HaTX62IQ
[5]2022ASCO | 恒瑞医药卡瑞利珠单抗联合阿帕替尼与注射用替莫唑胺一线治疗晚期肢端黑色素瘤研究亮相口头报告. Retrieved Jun 9 , 2022. From https://mp.weixin.qq.com/s/63vR0I-kToVyuYvjn86zJg

 会员动态
会员动态
 研发客
研发客  2025-12-23
2025-12-23
 52
52

 会员动态
会员动态
 先声药业
先声药业  2025-12-23
2025-12-23
 50
50

 会员动态
会员动态
 中国医药创新促进会
中国医药创新促进会  2025-12-22
2025-12-22
 27
27