 研发追踪
研发追踪
 医药魔方
医药魔方  2023-02-13
2023-02-13
 2934
2934
2月7日,Aldeyra宣布FDA已受理该公司外用眼科新药reproxalap滴眼液的新药上市申请(NDA),用于治疗干眼病。PDUFA日期为2023年11月23日。

干眼病是一种常见的炎症性疾病,该疾病的特点是患者眼睛前表面水分和润滑不足,从而出现眼睛干涩、炎症、疼痛等不适症状。这不仅对患者生活质量产生负面影响,甚至可导致永久性视力损害。在美国,约有3900万或更多的成年人受此疾病影响。Reproxalap是一款first in class小分子活性醛类物质(RASP, reactive aldehyde species)抑制剂,通过降低促炎性醛类物质的水平达到治疗目的。RASP含量在眼部或全身性炎症性疾病中升高,可造成眼睛发炎发红、泪液分泌量降低以及泪液内脂质组成改变,许多干眼病患者具有较高的RASP含量。
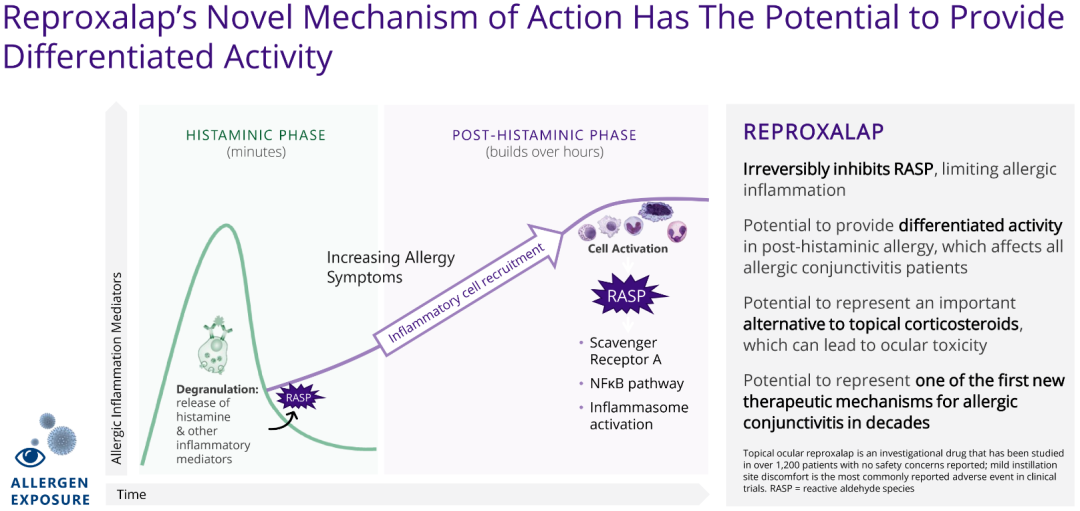
Reproxalap作用机制(来源:Aldeyra官网)
此次NDA受理是基于5项临床试验安全性和有效性积极结果,这些结果涵盖干眼病患者眼睛干涩症状评分、眼睛发红症状评估、Schirmer测试(评估眼睛产生的泪液量)以及Schirmer测试≥10mm的应答分析数据。
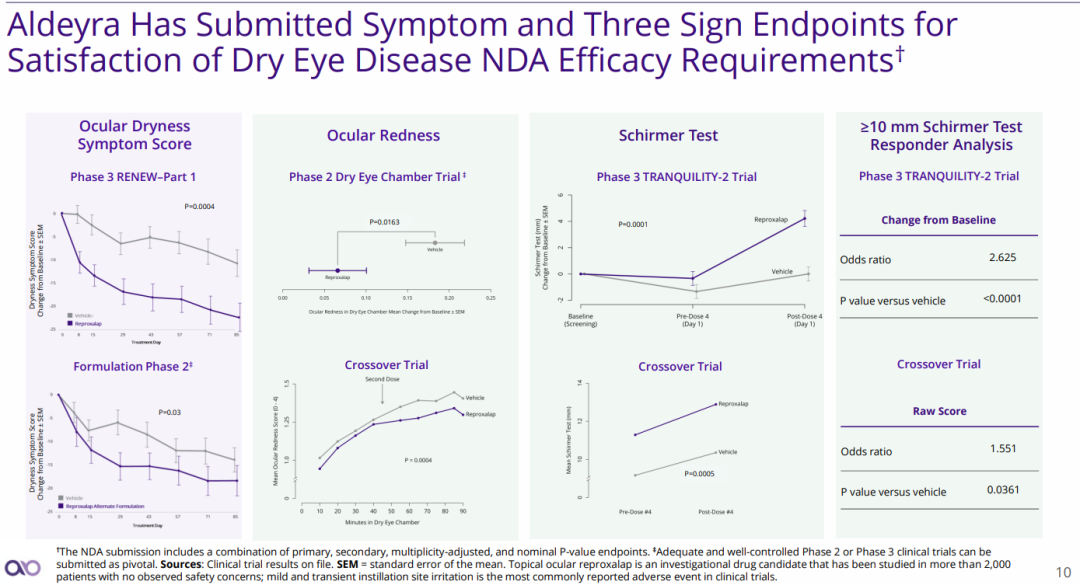
(来源:公司官网)
申请资料还包括通过交叉、平行临床试验评估的从给药几分钟起效到长达12周的疗效数据以及在干燥眼室(dry eye chamber)和自然环境评估的疗效数据。交叉、平行临床试验结果显示,当接受reproxalap治疗的患者进入干燥眼室仅10分钟后,与载体组相比,患者眼睛发红症状显著减轻,此现象一直持续到最后一个测量的时间点(90分钟)。此外,Aldeyra还提交了长达12个月的安全性数据。
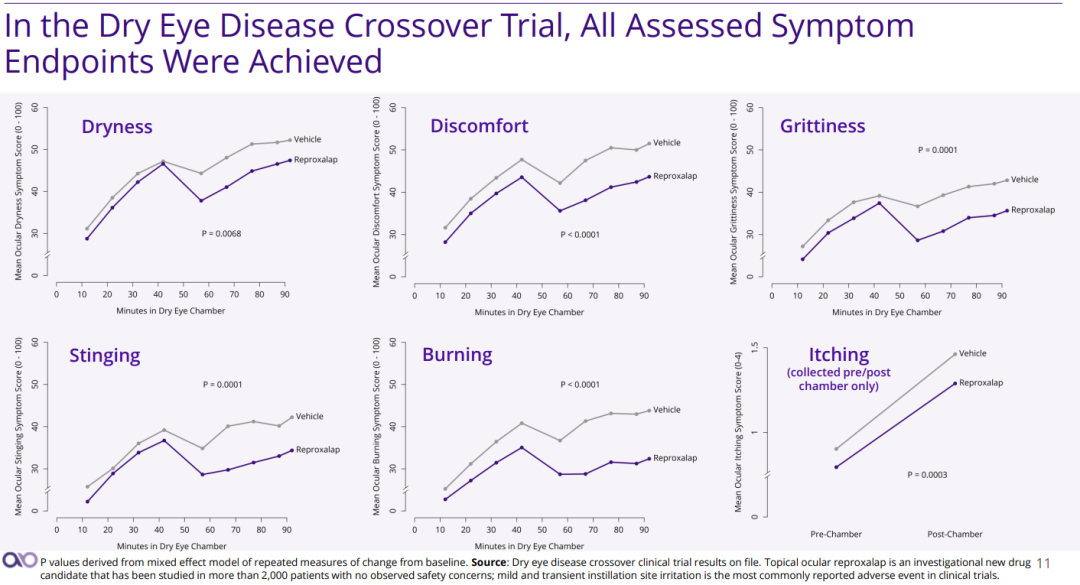
(来源:公司官网)
Aldeyra总裁兼首席执行官Todd C. Brady博士说:“此次NDA的受理标志着Aldeyra在将reproxalap推向市场用于治疗干眼病的一个重要的监管里程碑。基于一些后期临床试验数据,我们相信,对于数百万对现有治疗方法不满意的干眼病患者来说,reproxalap有潜力满足他们对快速起效且疗效持久眼科疗法的需求。”

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 131
131

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 130
130
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 135
135