 产业资讯
产业资讯
 药智网
药智网  2023-03-22
2023-03-22
 2503
2503
近日,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合开发的注射用德曲妥珠单抗(Enhertu)在中国获批上市。中国首款ADC新药CMG901(康诺亚生物、乐普生物)以超11亿美元总金额授权给阿斯利康(AstraZeneca)。
一时迎来业界欢呼:2023最热创新药属于ADC。
抗体偶联药物(ADCs)是通过特定的接头连接抗体和小分子细胞毒药物而形成的复合物,其主要成分包括抗体、接头和小分子细胞毒药物。
抗体分子主要起到靶向递送的作用,小分子药物发挥药效作用(一些抗体也具有抗肿瘤药效学作用)。抗体-药物偶联物作为治疗癌症的靶向疗法,与化学疗法的不同在于ADC旨在靶向并杀死肿瘤细胞,同时保留健康细胞。
与其他化疗药物相比,ADC药物通过抗原抗体的特异性结合,大大提高了给药的特异性。抗体与肿瘤细胞膜上的特异性抗原结合,诱导内吞作用,使抗体和附着在其上的细胞毒性小分子进入细胞,然后进行溶酶体降解。小分子药物释放到细胞内,通过DNA插入或抑制微管合成诱导细胞凋亡。
已获批的ADC药物的靶抗原通常是癌细胞中过表达的特异性蛋白,包括实体瘤中的HER2、trop2、nectin4和EGFR,以及血液恶性肿瘤中的CD19、CD22、CD33、CD30、BCMA和CD79b。
ADC的概念提出至今已有100多年的历史,但市场上的品种仍然很少,而且大部分在研品种还处于早期阶段。主要原因是ADC药物开发难度大,技术壁垒高。ADC药物进入体内后需要经过多个步骤才能发挥作用,每个步骤都有需要攻克的技术难点。
截至2022年底,FDA已批准15种不同的ADC,包括被通常认为是免疫毒素的Lumoxiti(moxetumomab pasudotox-tdfk),以及2020年上市,又于2022年退市的GSK的Belantamab mafodotin-blmf(Blenrep®)。本文对最近五年上市的九款ADC药物(不包括Blenrep®)进行梳理介绍。
01 Mirvetuximab soravtansine(Elahere)
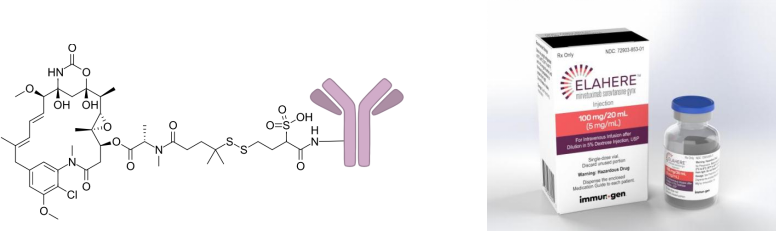
图片来源:Wikipedia(左),Drug.com(右)
开发商:ImmunoGen
适应症:铂类耐药卵巢癌
载荷药物:soravtansine(DM4,亦称ravtansine)
载荷药物药理:叶酸受体α
靶标:FRα
单克隆抗体:IgG1
接头类型:二硫键
FDA批准日期:2022年
Mirvetuximab soravtansine由靶向叶酸受体α(FRα)的单克隆抗体(M9346A)构成,通过可裂解的二硫键,共价连接到基因毒性化合物DM4(也称为soravtansine或ravtansine)。DM4以3.5:1.2的药物/抗体比与抗体偶联。
Mirvetuximab soravtansine的抗体成分与FRα结合,FRα是一种在上皮肿瘤细胞表面过度表达的受体,具有卵巢癌、子宫内膜癌、三阴性乳腺癌和非小细胞肺癌的特征。靶向结合形成后,mirvetuximab soravtansine被内化,DM4在细胞内释放。DM4导致细胞周期停滞和细胞凋亡,并且还能够扩散到邻近细胞并诱导进一步的细胞死亡。
2022年11月,FDA加速批准mirvetuximab soravtansine-gynx用于治疗既往接受过1-3种全身治疗方案的FRα阳性、铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。
02 Tisotumab vedotin-tftv(Tivdak)

开发商:Seagen Inc
适应症:复发性或转移性宫颈癌
载荷药物:MMAE(Monomethyl auristatin E)
载荷药物药理:微管抑制剂
靶标:组织因子
单克隆抗体:IgG1
接头类型:酶裂解
载荷/抗体比率:4:1
FDA批准日期:2021年
Tisotumab vedotin是一种组织因子导向的抗体-药物偶联物,由抗组织因子(TF,tissue factor)人IgG1-kappa抗体偶联至单甲基Monomethyl auristatin E(MMAE),这种载荷是微管破坏剂。载荷与抗体之间的缬氨酸Valine-瓜氨酸Citrulline接头可以通过蛋白酶裂解。每个单克隆抗体分子平均携带四个MMAE分子。
Tisotumab vedotin是第一个通过与实体瘤上表达的组织因子结合起作用的组织因子导向的ADC。组织因子是一种跨膜糖蛋白,是体内凝血途径的启动因子。组织因子是外源性凝血级联反应的主要发起者,在肿瘤相关的血管生成、进展和肿瘤存活转移中起着关键作用。它是癌症的新靶点,因为它通常在实体瘤(包括宫颈癌)上过度表达,并且与不良的临床结果相关。Tisotumab vedotin靶向表达组织因子的细胞,递送MMAE以杀死癌细胞。
2021年9月20日,FDA加速批准tisotumab vedotin-tftv用于治疗化疗期间或化疗后疾病进展的成人复发性或转移性宫颈癌。这是第一个也是唯一一个被批准用于该治疗适应症的抗体-药物偶联物。
03 Loncastuximab tesirine-lpyl(Zynlonta)
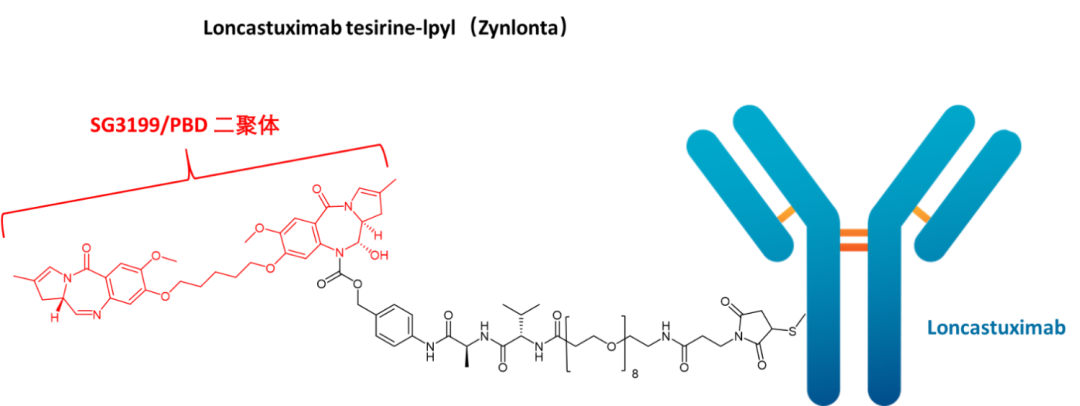
开发商:ADC Therapeutics
适应症:大B细胞淋巴瘤
载荷药物:SG3199(PBD二聚体)
载荷药物药理:DNA烷基化修饰
靶标:CD19
单克隆抗体:IgG1
接头类型:酶裂解
FDA批准日期:2021年
人CD19抗原是免疫球蛋白超家族中的一种膜糖蛋白,在B细胞发育的各个阶段表达。它在大多数B细胞来源的恶性肿瘤中被检测到。此外,CD19具有快速的内化动力学,不会进入全身循环,使其成为治疗B细胞恶性肿瘤的抗体药物偶联物(ADC)的有用治疗靶点。
Loncastuximab tesirine是一种抗体-药物偶联物,靶向人类CD19。它是一种人源化单克隆抗体,通过蛋白酶可裂解的缬氨酸-丙氨酸接头与SG3199偶联,SG3199是一种吡咯并苯并二氮卓(PBD,pyrrolobenzodiazepine)二聚体细胞毒素。单克隆IgG1 kappa抗体成分与位于B细胞表面的跨膜蛋白CD19结合。小分子成分SG3199充当烷化剂(alkylating agent)。与CD19结合后,loncastuximab tesirine内化到细胞中,随后蛋白水解裂解释放SG3199成分。SG3199与DNA小沟结合,形成细胞毒性DNA链间交联,导致B细胞死亡。
04 Sacituzumab govitecan(Trodelvy)

开发商:Immunomedics
适应症:既往接受过至少两种治疗的复发或难治性转移性疾病患者,转移性三阴性乳腺癌(mTNBC)成年患者
载荷药物:SN-38/camptothecin
载荷药物药理:TOP1抑制剂
靶标:TROP2
单克隆抗体:IgG1
接头类型:酸裂解
载荷/抗体比率:7.6:1
FDA批准日期:2020年
Sacituzumab govitecan是一种抗体-药物偶联物(ADC),靶向表达TROP-2的癌细胞,以诱导DNA损伤介导的细胞死亡。该偶联物包含人源化抗TROP-2单克隆抗体(RS7-3G11,也称为RS7),通过可水解的CL2A接头化学连接至细胞毒性药物SN-38。
作用机制首先涉及RS7成分与TROP-2的结合,TROP-2在多种癌症的细胞表面高度表达。RS7与TROP-2的结合导致结合抗体的快速内化,SN-38可能通过CL2A接头的水解在细胞内释放。SN-38是抗癌药物伊立替康(irinotecan)的活性代谢物,主要通过抑制DNA拓扑异构酶I发挥作用,从而导致DNA损伤和最终细胞死亡。
05 Trastuzumab deruxtecan(Enhertu)
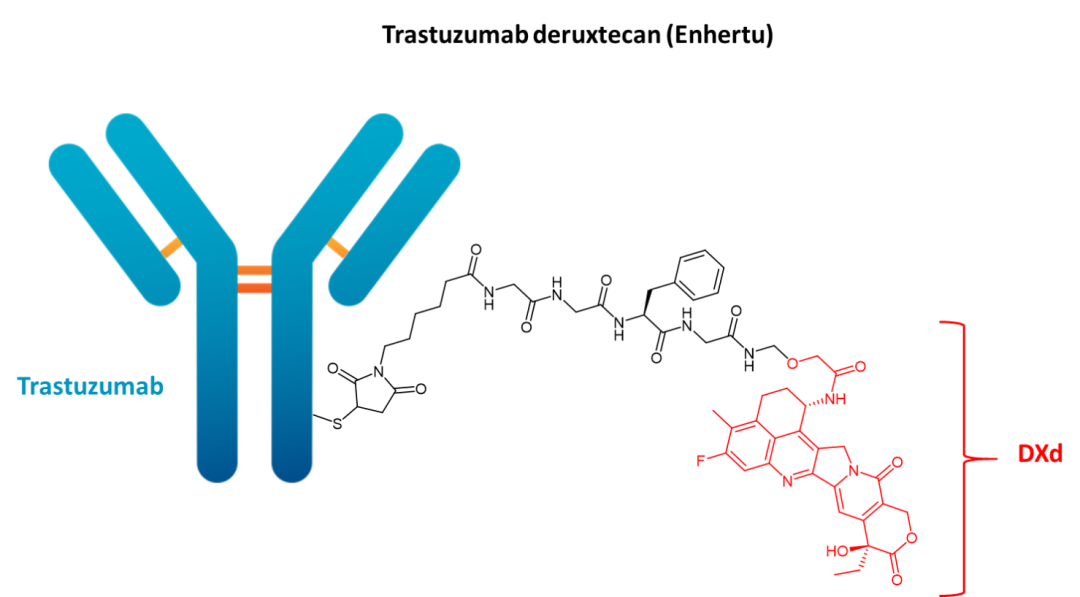
开发商:AstraZeneca/Daiichi Sankyo
适应症:患有不可切除或转移性HER2阳性乳腺癌,且已接受过两种或两种以上基于抗HER2方案的成年患者
载荷药物:DXd(deruxtecan)
载荷药物药理:TOP1抑制剂
靶标:HER2
单克隆抗体:IgG1
接头类型:酸裂解
载荷/抗体比率:8:1
FDA批准日期:2019年
Trastuzumab deruxtecan是一种人源化抗HER2(人类表皮生长因子受体2)IgG1抗体,靶向由HER2基因突变引起的癌症。该药物的小分子部分deruxtecan(DXd)是一种拓扑异构酶I抑制剂。它通过肽接头连接到抗体上。
在Trastuzumab deruxtecan与恶性细胞上的HER2结合后,它被内化并通过溶酶体酶的作用发生接头裂解。在通过裂解释放后,DXd由于能够穿过细胞膜,因此可以导致癌细胞中的靶向DNA损伤和细胞凋亡。
06 Enfortumab vedotin(Padcev)

开发商:Astellas/Seagen Genetics
适应症:已接受PD-1或PD-L1抑制剂和含铂疗法的局部晚期或转移性尿路上皮癌成年患者
载荷药物:MMAE
载荷药物药理:微管抑制剂
靶标:Nectin4
单克隆抗体:IgG1
接头类型:酸裂解
载荷/抗体比率:3.8:1
FDA批准日期:2019年
Enfortumab vedotin是一种抗体-药物偶联物。它包含一种针对Nectin-4的全人单克隆抗体,与化疗微管破坏剂单甲基奥瑞他汀E(MMAE)偶联,通过蛋白酶可切割的接头连接。
Nectin-4是一种在尿路上皮癌中高度表达的细胞外粘附蛋白。Enfortumab vedotin与表达Nectin-4的细胞结合,生成的enfortumab-Nectin-4复合物被内化到细胞中。一旦进入细胞,MMAE通过蛋白水解裂解从enfortumab vedotin中释放出来,并继续破坏细胞内的微管,阻止细胞周期并最终诱导细胞凋亡。
07 Polatuzumab vedotin-piiq(Polivy)
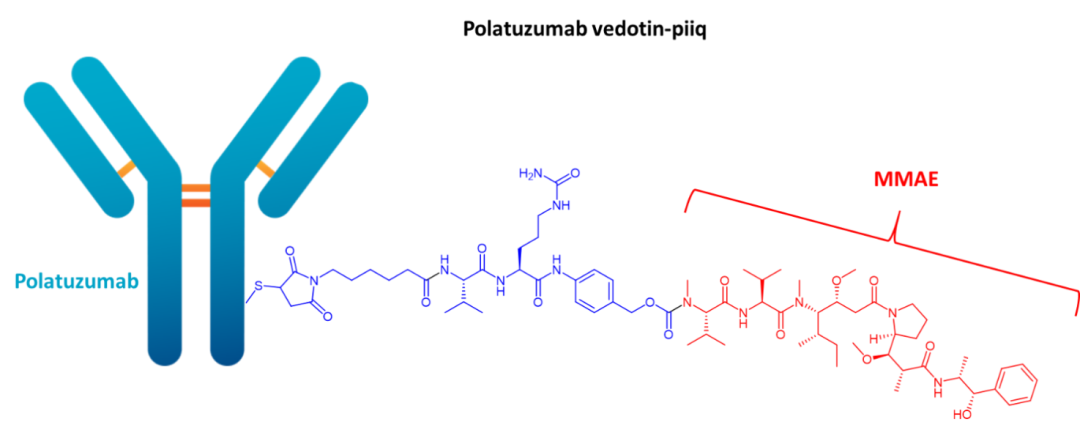
开发商:Genentech/Roche
适应症:复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)
载荷药物:MMAE
载荷药物药理:微管抑制剂
靶标:CD79
单克隆抗体:IgG1
接头类型:酸裂解
载荷/抗体比率:3.5:1
FDA批准日期:2019年
Polatuzumab vedotin由CD79b定向抗体,称为单甲基auristatin E(MMAE)的微管破坏剂,以及将这两个组分结合在一起的可切割接头组成。CD79是由CD79a和CD79b组成的异二聚体。负责信号转导的CD79与B细胞受体(BCR)形成复合物,几乎只在B细胞(包括恶性B细胞)上表达。CD79b作为一个有前途的治疗靶点越来越受到关注,因为它在B细胞受体表达、运输和功能(例如B细胞增殖和分化)中发挥重要作用。
一旦抗体成分与CD79b结合,polatuzumab vedotin就会被内化,溶酶体蛋白酶会裂解接头以在细胞中释放MMAE。MMAE是一种破坏微管的抗有丝分裂剂,对恶性B细胞具有细胞毒性作用。它与微管结合,通过干扰微管蛋白和微管蛋白聚合来抑制有丝分裂,并在分裂的B细胞中诱导细胞凋亡。
08 Moxetumomab pasudotox(Lumoxiti)
开发商:Astrazeneca
适应症:成人复发或难治性毛细胞白血病(HCL)
载荷药物:PE38
靶标:CD22
单克隆抗体:IgG1
FDA批准日期:2018年
Moxetumomab pasudotox是一种针对CD22的ADC。与正常B细胞相比,CD22是一种B淋巴细胞限制性跨膜蛋白,在HCL(毛细胞白血病)细胞中具有高密度。与CD22结合后,Moxetumomab pasudotox被内化和加工,从而释放毒素PE38。
Moxetumomab pasudotox中包含的毒素是假单胞菌外毒素A(Pseudomonas exotoxin A,PE38),这种毒素会抑制蛋白质翻译,从而导致高CD22表达的癌细胞进入凋亡状态。
09 Inotuzumab ozogamicin(Besponsa)
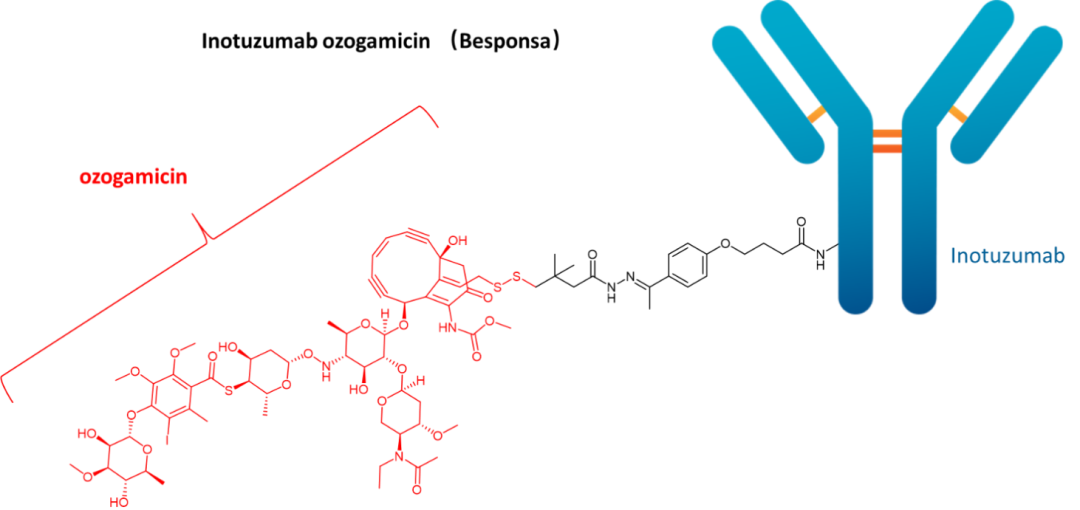
开发商:Pfizer/Wyeth
适应症:复发或难治性CD22阳性B细胞前体急性淋巴细胞白血病
载荷药物:ozogamicin/calichemicin
载荷药物药理:DNA裂解
靶标:CD22
单克隆抗体:IgG4
接头类型:酸裂解
载荷/抗体比率:6:1
FDA批准日期:2017年
Inotuzumab ozogamicin由细胞毒性抗生素N-acetyl-gamma-calicheamicin dimethylhydrazide(N-乙酰-γ-加利车霉素二甲基酰肼)组成,通过4-(4-乙酰苯氧基)丁酸(乙酰丁酸)接头连接到人源化单克隆IgG4抗体上。
当抗体与B细胞表面的CD22受体结合时,该药物对CD22+B细胞淋巴瘤产生有效的细胞毒性作用。药物-CD22复合物迅速内化到细胞中,形成随后与溶酶体融合的核内体。然后N-乙酰基-γ-加利车霉素二甲基酰肼在细胞内释放到酸性环境中。
N-acetyl-gamma-calicheamicin dimethylhydrazide是一种加利车霉素衍生物,由棘孢小单胞菌天然产生,未与抗体结合时对身体有毒。它通过以序列特异性方式结合DNA的小沟,并发生结构变化以产生双自由基来介导细胞凋亡。它们从双链DNA的磷酸二酯键中提取氢原子,导致DNA断裂和细胞凋亡。
参考来源:
1.Moore,K.N.et al.A review of mirvetuximab soravtansine in the treatment of platinum-resistant ovarian cancer.Future Oncol.2018,14,123-136.
2.Hong,D.S.et al.Tisotumab Vedotin in Previously Treated Recurrent or Metastatic Cervical Cancer.Clin Cancer Res.2020,26,1220-1228.
3.Zammarchi,F.et al.ADCT-402,a PBD dimer-containing antibody drug conjugate targeting CD19-expressing malignancies.Blood.2018,131,1094-1105.
4.Hamadani,M.et al.Final Results of a Phase 1 Study of Loncastuximab Tesirine in Relapsed/Refractory B-Cell Non-Hodgkin Lymphoma.Blood.2020,pii:474210.
5.FDA grants accelerated approval to loncastuximab tesirine-lpyl for large B-cell lymphoma.
6.Stein,R.et al.Specificity and properties of MAb RS7-3G11 and the antigen defined by this pancarcinoma monoclonal antibody.Int J Cancer.1993.55,938-946.
7.Bailly,C.Irinotecan:25 years of cancer treatment.Pharmacol Res.2019,148,104398.
8.Tamura,K.et al.Trastuzumab deruxtecan(DS-8201a)in patients with advanced HER2-positive breast cancer previously treated with trastuzumab emtansine:a dose-expansion,phase 1 study.Lancet Oncol.2019,20,816-826.
9.FDA Approved Drug Products:Enhertu(fam-trastuzumab deruxtecan-nxki)for injection,for intravenous use.
10.Hanna,K.S.Clinical Overview of Enfortumab Vedotin in the Management of Locally Advanced or Metastatic Urothelial Carcinoma.Drugs.2019,pii:10.1007.
11.FDA Approved Drug Products:Padcev(enfortumab vedotin-ejfv)for IV injection.
12.Deeks,E.D.Polatuzumab Vedotin:First Global Approval.Drugs.2019,79,1467-1475.
13.Assi,R.et al.Polatuzumab Vedotin:Current Role and Future Applications in the Treatment of Patients with Diffuse Large B-Cell Lymphoma.Clin Hematol Int.2021,3,21-26.
14.FDA Approved Drug Products:POLIVY(polatuzumab vedotin-piiq)for injection,for intravenous use.
15.Park,J.H.et al.Targeted immunotherapy for hairy cell leukemia.J Clin Oncol.2012,30,1888-1890.
16.Thota,S.et al.Inotuzumab ozogamicin in relapsed B-cell acute lymphoblastic leukemia.Eur J Haematol.2017,98,425-434.
17.Thota,S.et al.Inotuzumab ozogamicin in relapsed B-cell acute lymphoblastic leukemia.Eur J Haematol.2017,98,425-434.

 产业资讯
产业资讯
 研发客
研发客  2025-05-13
2025-05-13
 52
52

 产业资讯
产业资讯
 药智数据
药智数据  2025-05-13
2025-05-13
 47
47

 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-05-13
2025-05-13
 48
48