 产业资讯
产业资讯
 IQVIA艾坤纬
IQVIA艾坤纬  2023-03-23
2023-03-23
 2337
2337
导 读
全球处方药市场已逐渐从疫情早期的剧烈波动中恢复,在仿制药的推动下,销售额已重新恢复增长。COVID-19疫苗和治疗创造出了巨大的市场,据IQVIA估计,到2026年,COVID-19疫苗的累计市场规模可能达到1850至2950亿美元。然而,非COVID-19类创新药的价值增长却陷入困境——从2020年起,除某些例外情况,创新药在美国、EU4+英国、日本和中国等国家上市销售业绩不佳,低于疫情前的新药业绩基准,而上述国家通常对全球业务成功至关重要,其销量占典型新活性物质(NAS)上市前五年累积销售额的90%以上。
1 业绩问题诊断
① 上市前流程继续发挥作用
新药商业上市的第一步是监管审批。对于大多数的主要上市国家而言,积极的卫生技术/市场准入评估可推动纳入报销并实现有利的市场份额。我们首先评估了这些关键流程的弹性。
(1)监管机构的良好适应性
2020年和2021年,FDA和EMA的新活性物质批准均处于历史高位(图1)。除了评估COVID-19疫苗和治疗的额外需求,监管机构仍在持续批准非COVID-19药品。
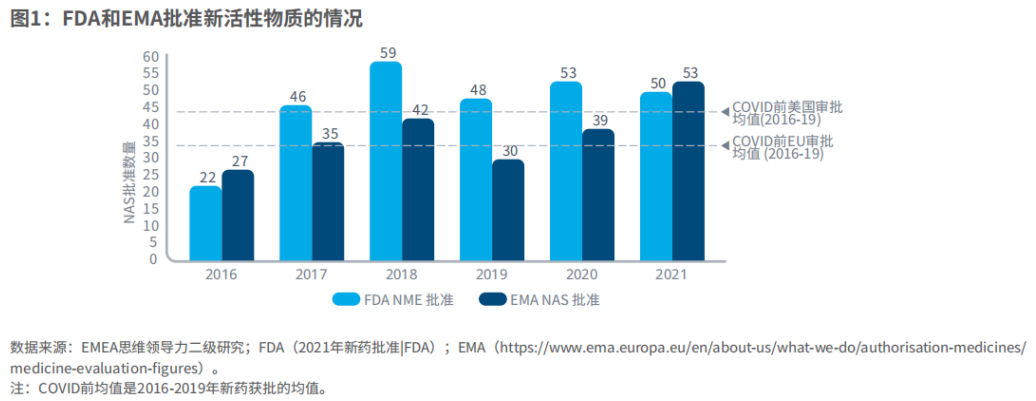
(2)药企持续上市产品
药企本可以选择在疫情早期推迟上市新活性物质,但事实上,根据IQVIA判断,创新药物进入商业渠道的速度高于疫情前或与疫情前的基准持平。
② 疫情后(以下均指后疫情时代)上市产品的业绩问题
新产品上市了,但它们是否实现了商业潜力?平均来看,在上市前5年实现90%以上药品销售业绩的8个国家中,答案是否定的。
(1)疫情后业绩不佳较为严重
图2显示了所有新活性物质按时间轴划分在美国、中国、欧洲五国和日本的月平均销售额。在疫情后上市的产品中,第六个月的平均销售额比疫情前的基准下降了19%。虽然疫情后上市产品的销售额损失可受多重因素影响,但用平均值简单估算,疫情后上市产品的前六个月的销售额,相较于它们若是在疫情前上市,可能减少了4.4亿美元。
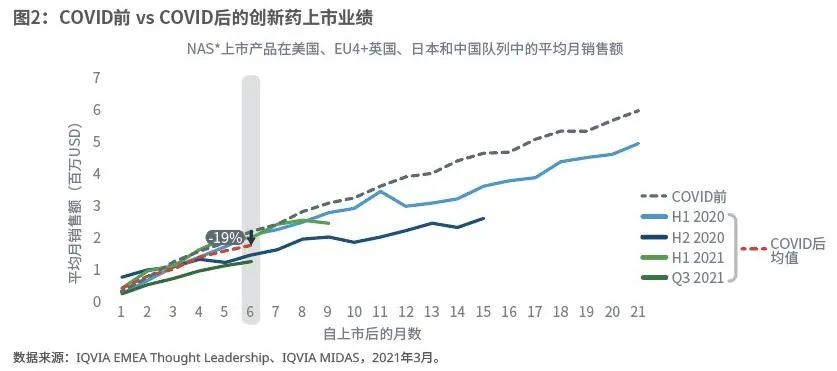
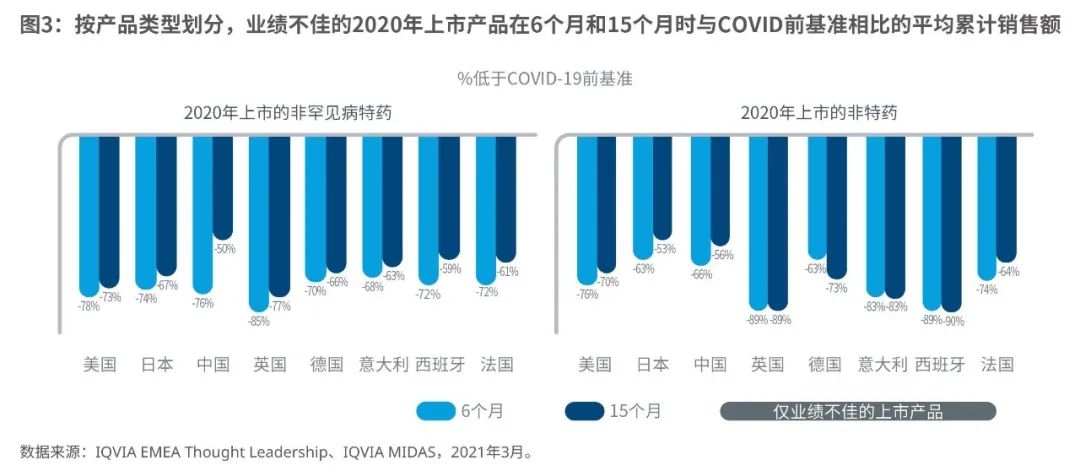
(2)业绩不佳的2020年上市产品尚未从缓慢起步中恢复过来
平均而言,在许多国家,2020年业绩不佳的非特药和非罕见病特药上市产品,在15个月后表现出一定的改善(图3),但并未绝地反弹。尽管我们还没有足够的疫情后上市产品样本和18个月的销售额来进行6个月窗口期分析,但早期证据表明这个窗口仍然适用。如果COVID-19后许多积压患者仍然需要治疗,复苏也许是可能的,我们在下一章中进行了探讨。
2 疫情后环境中的挑战
疫情造成了一系列影响,为了成功上市,企业必须对这些不断发展的动态有一个清晰的了解,并尽早采取行动来调整其上市计划。
① 患者旅程已彻底改变
(1)由于疫情,诊疗旅程变得更漫长、更复杂,且更易有漏洞,患者的治疗机会被压缩
治疗和诊断方面的积压仍然存在,在一些疾病领域,一些患者可能永远无法得到诊断和治疗。在最具创新的治疗领域如肿瘤学,由于筛查、诊断、治疗和手术的延迟和取消,整个市场都出现了严重的治疗积压,导致患者长时间处于等待和焦虑。
已确诊的患者也不能从新上市产品中获益。面对面看诊的减少意味着医务人员评估治疗进展的机会减少,也意味着一些患者接受的治疗可能已不再适宜。由于这些患者已经在系统中,因此他们被遗忘的风险最大,尤其是还有许多尚未被诊断的患者的积压。
(2)医生仍然不愿意远程开具处方新药
当处方医生不愿意远程开具新药时,优化现有疗法的药物的上市比针对高度未满足需求的药物上市更具挑战性。同样,与已经接受治疗的患者相比,处方医生更有可能向新患者开具新药。但总体而言,与COVID-19前总体水平相比,医生仍然不愿让病情稳定的患者转换用药。在面对面就诊较少的不确定环境中,医生开具处方时可能会更加保守。
② 药企与医生互动的数量和质量已彻底改变
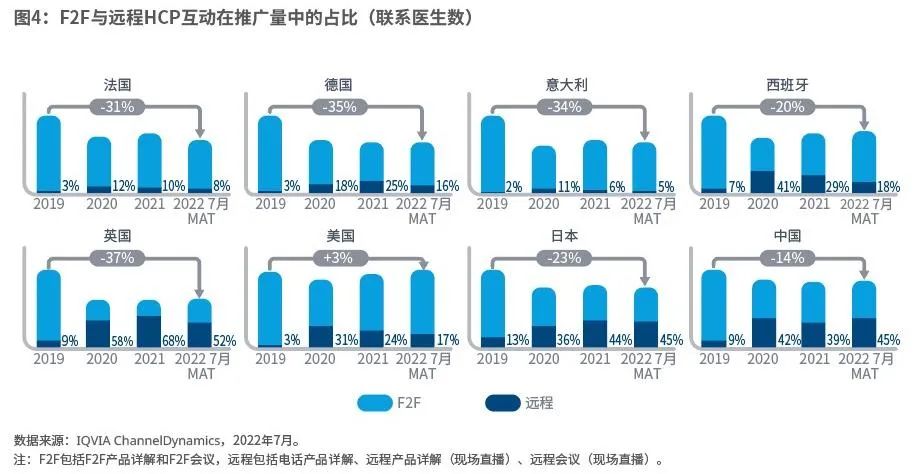
(1)药企与HCP的互动时间仍然较少
药品上市需要与医生互动以提高意识、解答问题和建立认知。最重要的是,在欧洲、日本及中国,无论是远程还是面对面,药企与医生的互动宣传时间总量都还没有恢复到疫情前的水平(图4)。这对产品上市的影响最大。
(2)仅靠传统渠道效率不足
医药代表和医生之间的面对面接触对药品上市一直是极为重要的,并且历来被认为是推动上市的关键。2020年期间,推广渠道组合显著向远程/数字渠道倾斜。企业不得不超越传统渠道来接触HCP。IQVIA研究发现,相当一部分HCP表示,有虚拟互动在未来基本就足够了。尽管许多HCP仍然高度重视面对面互动,但如果想接触到更多HCP,药企就必须投资其数字能力,补充而非取代面对面互动形式。
③ 更广泛的经济挑战将影响创新药物的预算
(1)新政策控制了处方药市场的成本
尽管纳入国家医保目录通常需要降价,但是中国市场对新产品上市的重要性将继续上升,盈利能力仍将面临挑战。
(2)市场准入和融资变得更具挑战性
尽管药企试图证明其全面市场准入的价值,但是获批适用人群与医疗系统覆盖人群之间的差异越来越大,这种差距或是长久地限制了产品潜力,或是延长了上市时间。这一趋势虽然并非源于疫情,但毫无疑问因疫情以及当前的经济挑战而被扩大。
3 实现疫情后的卓越上市
企业需要采取什么措施才能实现疫情后的卓越上市?
(1)了解患者旅程,确定加强诊疗路径的策略
准备上市产品的药企必须尽早、详细地了解疫情后患者旅程如何改变,识别并解决诊疗障碍。患者旅程越复杂,中断的可能性就越多,罕见病和专科治疗也往往如此。
拓宽患者筛查:加强患者旅程从患者筛查开始,鼓励HCP识别患者,鼓励患者寻求治疗。筛查计划是为某些疾病建立患者群体的有力方式。这很可能是两种脊髓性肌萎缩症(SMA)产品Zolgensma(一种基因治疗)和Evrysdi(一种口服药物)卓越上市的成功关键之一。
支持医疗健康服务:准备产品上市的企业还需要通过为护士和HCP提供支持,利用数字/远程监控设备,智能技术和可穿戴设备,帮助卫生系统识别因治疗不足而陷入困境的患者。疫情加大了对卫生系统能力的限制,这对获得治疗但未得到最佳治疗的患者构成了重大挑战。更换用药成为市场准入的一个挑战。
(2)优化各个参与机会
与HCP互动的减少和变化是上市产品面临的主要挑战。药企必须寻求他们能够获得的每一个互动机会,并对每一个互动进行优化。为了实现上市成功,企业需要专注于:
多元渠道参与:由于疫情,大多数HCP参与到了更广泛的渠道中,而且这种情况还在继续。企业必须建立多矩阵渠道沟通能力和专业知识,并且对之协调优化,以达到最佳效果。
相关内容:在疫情之前,IQVIA就表明卓越上市产品与高水平的真实世界证据内容出版生产力相关。在互动机会较少的环境中,RWE是强大的工具,它提供了令人信服的理由与HCP接触并重建被疫情削弱的关系,同时也为产品的价值和相关性提供基于证据的见解。
关注点细化:根据HCP个人需求对内容和消息通信进行个性化处理。IQVIA的《2022年渠道偏好》研究发现,医生的首选渠道和实际接收渠道之间的一致性较低。HCP对何时、何地以及如何接收信息有不同的偏好,对医生偏好的细致了解将是确保和优化参与的关键。
(3)药企必须建立强有力的综合证据策略
疫情后,强有力的综合证据策略将更加重要。除了重建与HCP的互动机会外,RWE对于解决更严格的市场准入和融资决策至关重要。用于创新药的预算将变得更加有限,而准入证据标准将继续提高。正如我们发现的那样,由于准入通常仅限于新上市产品的某适应症人群,因此应使用RWE来识别最有效的患者群,并为扩大准入提供理由。IQVIA分析表明,对于罕见病,在大多数审批途径中,包含RWE的药物获批会更快。然而更重要的是,支付方开始公开认可使用RWE来补充RCT数据。最新的《NICE卫生技术评估手册》正式确定了RWE作为证据来源的可接受性。
4 2030年展望
即使没有疫情,创新上市产品的环境也越来越具挑战性。随着上市产品从基础治疗市场转型为专科治疗市场,上市产品在关键治疗领域的竞争越来越快,后续产品在两年内取得的市场份额越来越少。
面对这种情况,速度是关键:加快临床开发速度,率先进入市场;加快商业化速度,在竞争对手到来之前建立市场。疫情环境只是在这一挑战的基础上进一步增加了复杂性,为业绩带来压力。
目前的迹象表明,疫情早期的上市产品,如果业绩不佳,将很难挽回失去的商业机会。从现在开始,拥有上市产品的公司必须从具有韧性的疫情产品中吸取经验,并尽早做好准备,以实现疫情后的卓越上市。企业需要为冲刺做好投资,也要为长跑做好准备。

 产业资讯
产业资讯
 研发客
研发客  2025-05-13
2025-05-13
 52
52

 产业资讯
产业资讯
 药智数据
药智数据  2025-05-13
2025-05-13
 47
47

 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-05-13
2025-05-13
 48
48