 研发追踪
研发追踪
 医药魔方
医药魔方  2023-05-08
2023-05-08
 3019
3019
5月3日,礼来宣布donanemab治疗早期症状性阿尔茨海默病(AD)患者的III期TRAILBLAZER-ALZ 2研究达到了主要终点。结果表明,donanemab能显著减缓早期症状性AD患者的认知功能下降,近一半受试者(47%)在1年内没有疾病进展(定义为临床痴呆评分没有下降),而安慰剂组为29%。礼来预计本季度向FDA递交donanemab的上市申请,以寻求加速批准。

该消息公布后,礼来股价大涨6%,市值突破4000亿美元,超越诺和诺德(3780.7亿美元)成为纯药企市值第一名。
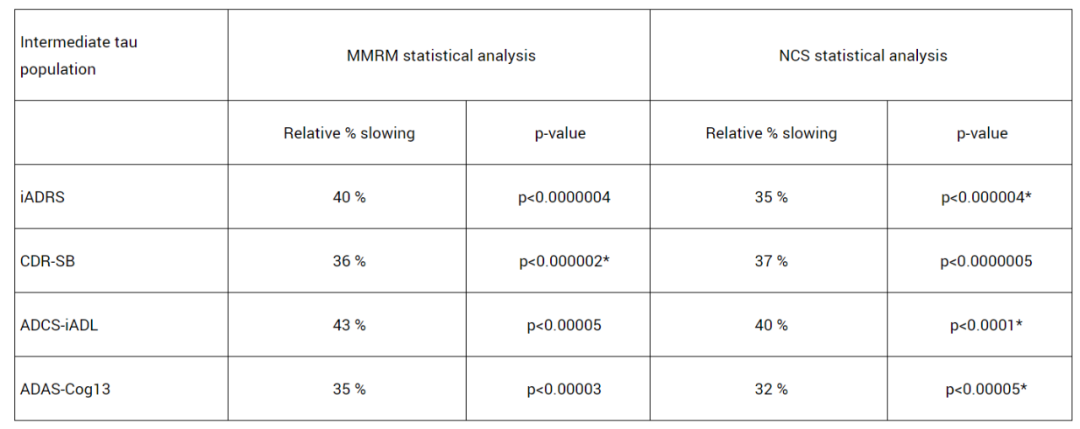
TRAILBLAZER-ALZ 2是一项随机、双盲、安慰剂对照的III期临床研究,主要分析人群(n=1182)为tau蛋白水平中等且有明显AD临床症状患者。主要终点是AD综合评定量表(iADR,评估患者的认知能力和生活自理能力)评分从基线到18个月的变化,关键次要终点包括基线至18个月的临床痴呆评定量表(CDR-SB,评估患者的认知能力)评分、AD协作研究日常生活能力量表(ADCS iADL)评分、AD认知量表(ADAS-Cog13)评分的变化等。
结果显示,与安慰剂组相比,接受donanemab治疗组患者的iADRS评分下降速度减缓了35%(p<0.0001);18个月时,donanemab组CDR-SB评分较安慰剂组下降速度减缓了36%(p<0.0001);ADCS iADL评分显示,18个月时,donanemab组疾病进展速度延缓了40%(p<0.0001)。此外,donanemab将患者疾病进展到下一阶段的风险降低了39%(HR=0.61; p<0.001)。
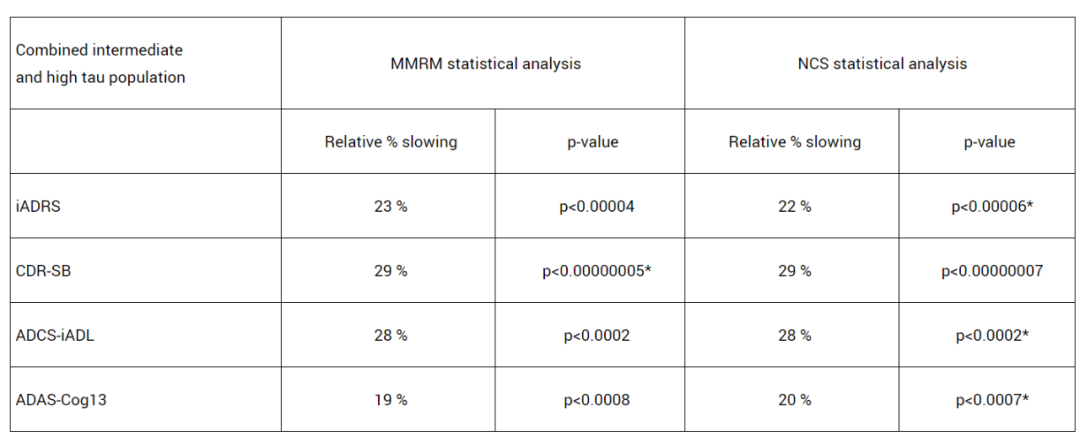
将tau蛋白水平中等人群与较高人群(n=552)结果合并分析后(n=1736),donanemab治疗组仍在所有临床终点中显示出有积极结果(p<0.001),其中CDR-SB评分和iADRS评分分别将下降速度减缓29%和22%。
安全性方面,donanemab组有24%受试者出现淀粉样蛋白相关影像学异常-水肿(ARIA-E),有症状ARIA-E发生率为6%;donanemab组有31.4%患者出现脑微出血和浅表铁质沉积(ARIA-H),安慰剂组为13.6%。大多数ARIA的严重程度为轻度至中度,严重ARIA发生率为1.6%,包括两例死于ARIA的受试者和经历严重ARIA后死亡的患者;有8.7%患者出现输液相关反应,大多为轻度至中度。

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 86
86

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 88
88

 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 90
90