 产业资讯
产业资讯
 2016-01-27
2016-01-27
 3299
3299
来源:Insight数据库 2016-01-26
已经结束的 2015 是药品政策剧变、行业震荡的一年,震荡之余,我们依然要保持着向上的状态,用大数据来阐述这一年 CDE 的真实审评情况。
根据 Insight-China Pharma Data 数据库统计,2015 年 CDE 共承办新的药品注册受理 8217 个(以受理号计,见图 1)。
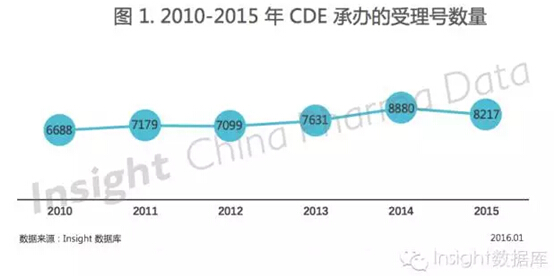
如图 1 所示,2014 年申报受理数量达到最高峰,2015 年则有所下降。据 Insight 统计,2015 年上半年申报受理数量还略高于 2014 年同期水平,下半年就下降了,可见 2015 年解决药品积压受理的种种政策起到了一定作用。
就 2015 年而言,1-7 月,除了 5 月受注册涨价影响稍有减少以外,CDE 承办的受理号数量一直总体持续增长,8 月出台一系列的解决积压受理政策和意见之后,申报数量整体下降明显。
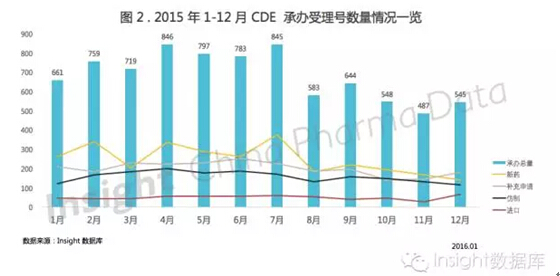
如图 2 所示,各个申请类型中,新药和仿制药的申报数量受政策影响波动较大,而进口药品的申报数量则相对平稳一些。
受到 7-12 月自查核查风暴和 12 月仿制药生物等效性试验备案管理备案政策实施的影响,12 月新药和仿制药申报数量都有所下降,补充申请和进口申请则显著增加。看来国内企业日子不好过,而外资企业不太受影响。
以下,分别来回顾 2015 年化药、中药、生物制品的申报受理情况。
一、化药申报受理情况
仿制药、进口药申报分别缩水 10.5% 和 18.4%
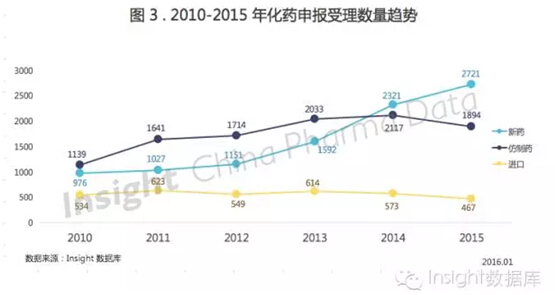
前面已经提过,2015 年的整体申报数量相比 2014 年是有所下降的,其中化药占了大部分。
具体看来,对比化药新药、仿制药和进口药的申报数量,仿制药和进口药申报分别有 10.5% 和 18.4% 的缩水;新药申报仍然上涨,但可以看出增速有所放缓。
1、新药申报受理情况
2015 年 1-12 月,平均每月有 16 个 1.1 类新药注册申请被 CDE 受理,且总体看来每月的申报数量比较平稳(见图 4)。
3.1 类新药申报数量波动很大,7 月达最高峰,8 月之后 3.1 类新药申报数量趋势明显走低,12 月降至最低,相差达 2.5 倍。
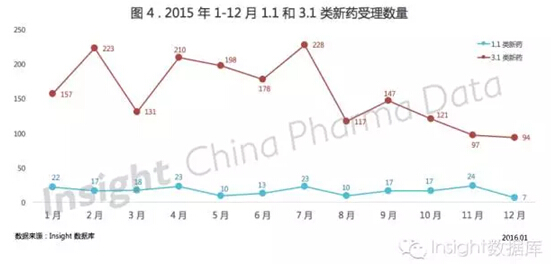
2015 年 3.1 类新药的申报热情暂时被化药注册新分类和仿制药一致性评价浇灭了不少,但瞄准 3.1 类新药的企业会坐以待毙还是一如既往热衷这类候选药物,目前还不能下定论。
1)1.1 类新药申报持续增长
根据 Insight 数据库统计,新申报的化药 1.1 类新药申请以受理号计有 201 个,数量在持续增长。
2015 年新申报的 1.1 类新药共涉及 76 个品种,其中仅江苏恒瑞的磷酸瑞格列汀片和北京康辰药业的注射用盐酸诺拉曲塞申报上市,目前瑞格列汀已完成了药理毒理专业项审评,排在 NDA 队列的 274 位;而诺拉曲塞的审评结论则为批准临床。
每个月新申报的 1.1 类都在 Insight 每月审评报告中有详细介绍,在此不赘述。
(微信关注 Insight 数据库,回复「2015」打包下载每月药品审评报告。)
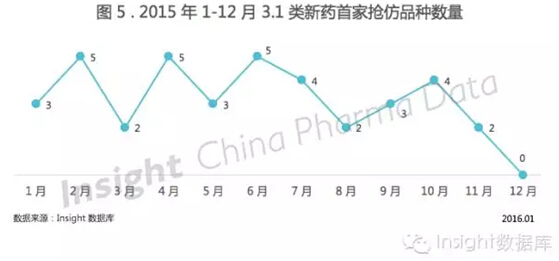
2)3.1 类首家抢仿的热潮与冷却
3.1 类新药除了申报总数受到政策变化影响以外,首家抢仿申报也经历了一轮热潮与冷却。
如图 5 所示,8 月之前,平均每月有 3-4 个品种被国内企业首家抢仿,其中不乏原研企业在全球刚批准上市,国内企业就已申报抢仿的品种。
8 月之后,抢仿数量明显下降,12 月虽有 3.1 类品种申报,但首家抢仿却是空白。
2、仿制药申报受理情况
仿制药申报数量降幅为 10.5%
2015 年 11 月 18 日,CFDA 发布征求《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》意见。
这意味着仿制药质量终于得到重视,随之而来的是企业研发成本的增加,仿制药将不再那么容易被「仿制」,加上规定期限内未完成一致性评价注销文号或动作慢了就无法在集中采购中胜出的种种限制,2015 年仿制药申报数量的减少在意料之中。
事实上,从 2014 年开始,仿制药申报量已经减少,至 2015 年降幅达 10.5%。
3、进口药申报受理情况
年末进口药申报数量开始爬升
今年的政策局面无疑是利好外资企业的,无论是提高仿制药质量使得国内企业要面临许多挑战,还是临床试验自查核查的撤回风暴,外资企业都损失较小。
虽然 2015 年进口药申报量不如 2014 年,但从 2015 年 1-12 月的进口药申报趋势来看(如图 2),12 月进口药申报量已经开始上升,且 12 月首次申报进口的数据大多为全球在研药物。
可见,在这样利好的局面下,外资企业已经开始发力,来巩固在华的业务。
二、中药申报受理情况
中药申报数量明显下降
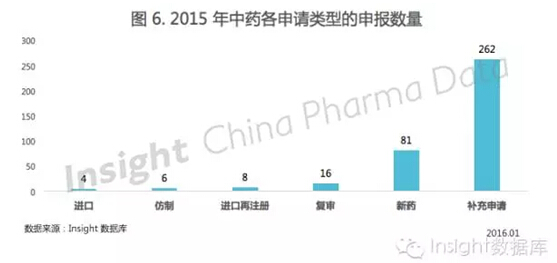
根据 Insight 数据库,2015 年申报的中药申请以受理号计共 377 个,相比 2014 年的 531 个申请,申报明显下降。
2015 年的具体申请类型如图 6 所示:
三、生物制品申报受理情况
生物制品市场扩容 18.6%
2015 年申报的生物制品申请以受理号计共有 558 个,相比 2014 年的 454 个申请,申报量涨了 18.6%。
2015 年的具体申请类型如图 7 所示:
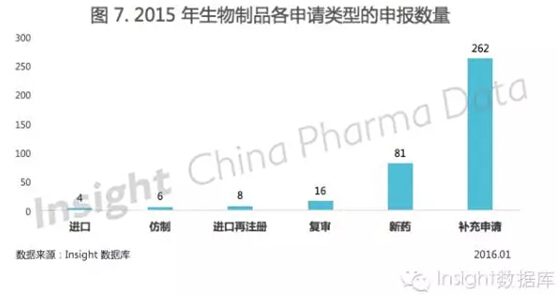
其中,1 类生物制品以受理号计共 37 个。
1 类生物制品的 35 个临床申请中,有 3 个品种在一年内获得了临床批件,分别是北京科兴的 Sabin 株脊髓灰质炎灭活疫苗(Vero 细胞)、泰州君实的重组人源化抗 PD-1 单克隆抗体、以及军科院生物工程研究所研发的重组埃博拉病毒病疫苗。
另外,今年只有 2 个 1 类生物制品申报上市,分别为上海仁会生物的贝那鲁肽注射液、成都康弘生物的康柏西普眼用注射液。
上海仁会生物的贝那鲁肽是重组人胰高血糖素类多肽-1,该药上市申报受理号在 722 公告列表中,目前还没有结论。
康柏西普是 2013 年批准用于治疗湿性年龄相关性黄斑变性的新药,2015 年新的上市申请有可能为新适应症。
至此,2015 年中国药品申报已经盘点完,敬请期待「2015 年中国药品审评和批准大盘点」。

 产业资讯
产业资讯
 研发客
研发客  2025-07-19
2025-07-19
 7
7

 产业资讯
产业资讯
 动脉网
动脉网  2025-07-19
2025-07-19
 8
8

 产业资讯
产业资讯
 阿基米德Biotech
阿基米德Biotech  2025-07-19
2025-07-19
 6
6