 产业资讯
产业资讯
 研发客
研发客  2025-07-19
2025-07-19
 699
699
•日本处方药注册分类复杂,不同分类申请时需提交申报资料要求不同,制药公司开发初期要自行确认分类,且申请错误可能会不被受理,所以务必要事先向PMDA确认。
•注册分类包括含新活性成分的药品、新复方制剂处方药、新给药途径药品等十类,还涉及微小变更。
•申报资料要求或注册申请书应附带资料需对照文中表2和表3按注册分类准备,CTD模块3、4、5原文英文可直接提交,模块2须用日文,但MHLW已发出符合条件的外国企业申请注册新药时允许使用全部英文CTD的试行通知,使用需事先与PMDA协商。
本连载的系列B将介绍日本药品监管制度的基本信息。这一期谈一谈处方药的注册分类。由于在申请时需要提交的资料要求因分类不同而不同,制药公司有必要在开发初期根据相关通知自行确认其开发品种属于何种注册分类。
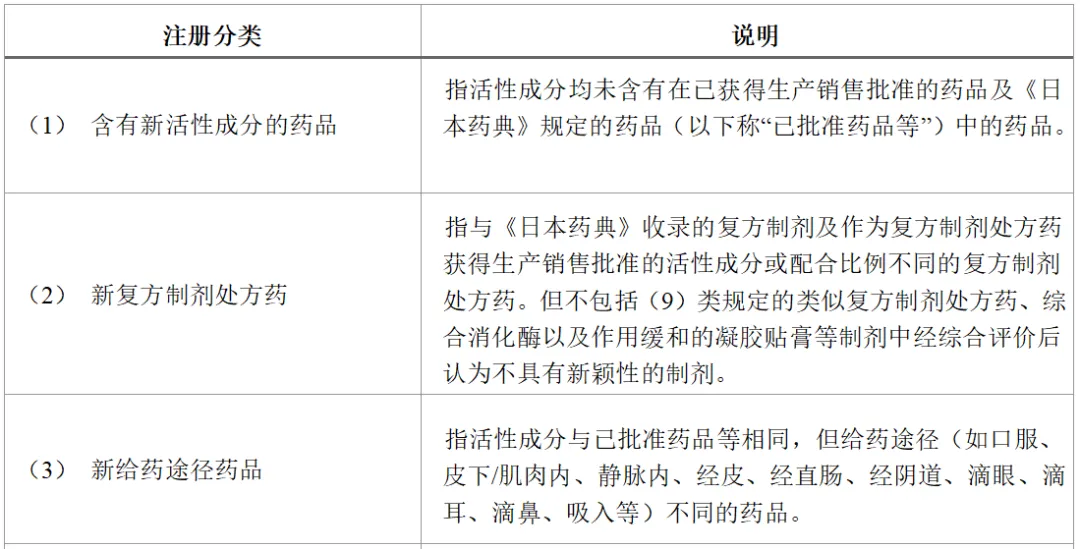
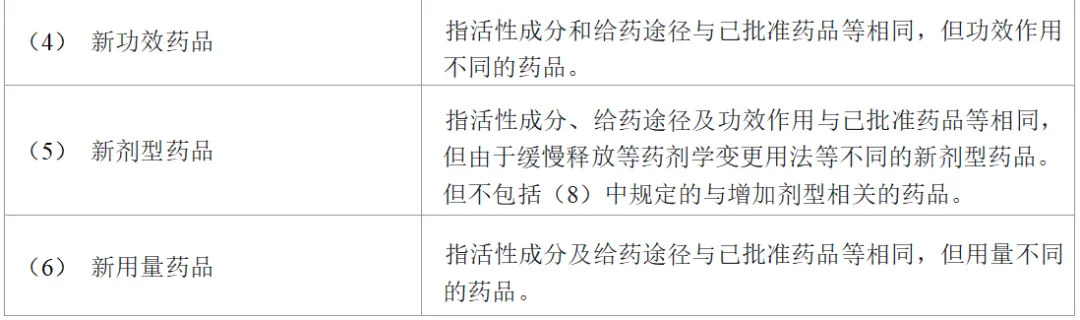
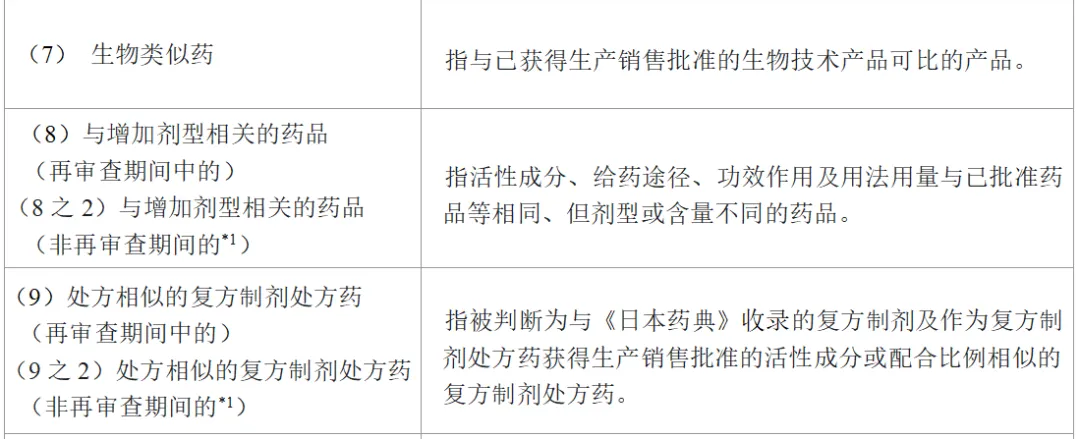
表1所示为日本处方药的注册分类。
申请含有新活性成分的药品时,注册分类为(1)。批准事项包括功效作用、用法用量、给药途径及剂型。在含有新活性成分的药品批准后,制药公司若想申请对自家已批准药品进行任何批准事项的变更,需进行批准事项的一部分变更申请(即对应中国的补充申请)。例如,申请增加新的功效作用时,注册分类为(4)。此时,若因新增功效作用而需要同时增加新剂型时,注册分类则同时为(4)和(5),若还需变更用法用量,则还需加上(6)。即,一次补充申请中,注册分类可能为(4)、(5)及(6)。
另外,在原研药品的再审查期限(原则上为8年,在此期间仿制药不能获得批准)结束后,仿制药生产商同时申请多个含量不同的仿制品制剂时,有需要注意的地方。即,为了申请注册仿制品,需要提交生物等效性试验的数据。比如,同时申请仿制药5mg片剂和10mg片剂时,确认了5mg片剂与原研药品的等效性,而10mg片剂是与自家的5mg片剂进行的等效性评价,在这种情况下,5mg片剂的注册分类属于(10之3),而10mg片剂则属于(8之2)。
由此可见,注册分类具有复杂性,若申请错误可能会不被受理,所以务必要事先向PMDA确认。
表1 日本处方药的注册分类

*1:“非再审查期间的”是指原研药品的再审查期限已结束,即可以申请注册仿制药及生物类似药。
表2所示为申报资料要求或注册申请书附带的(应包含在注册申请中的)资料。需将此与表3的内容对照,按照注册分类准备应附带的资料。也就是说,在按照ICH-M4准备附带资料时,需按照注册分类,基于表2和表3选择并准备必要的资料。CTD模块3、4及5若原文为英文,可直接提交,但模块2必须用日文撰写。另外,MHLW已发出试行通知(2024年9月6日),对于没有日本法人或日本事务所的外国企业在日本申请注册新药时,CTD的全部内容允许使用英文撰写。使用该通知时,也需要事先与PMDA协商。
表2 申报资料要求(注册申请书应附带的资料)
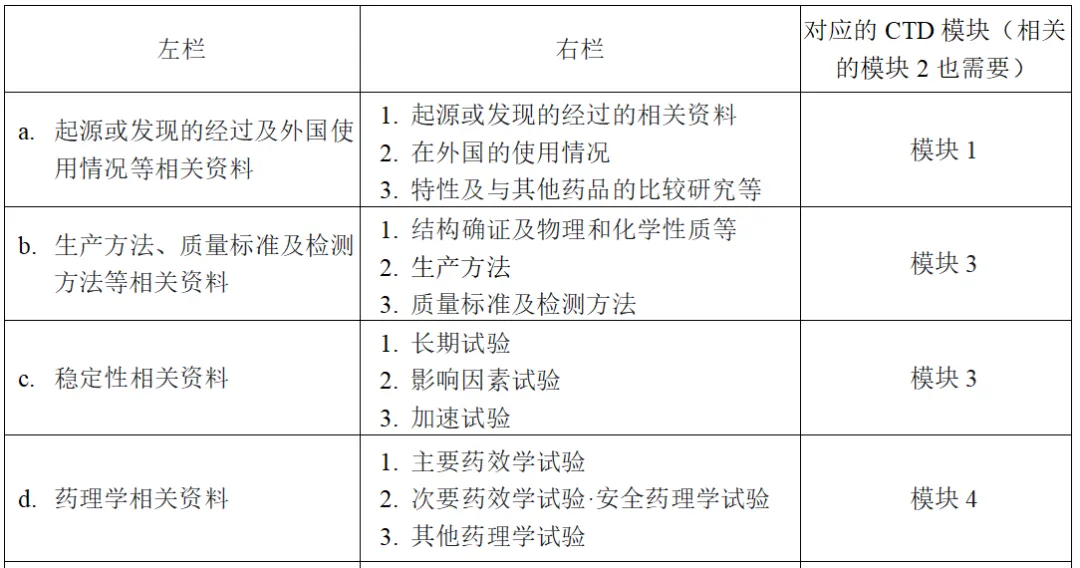
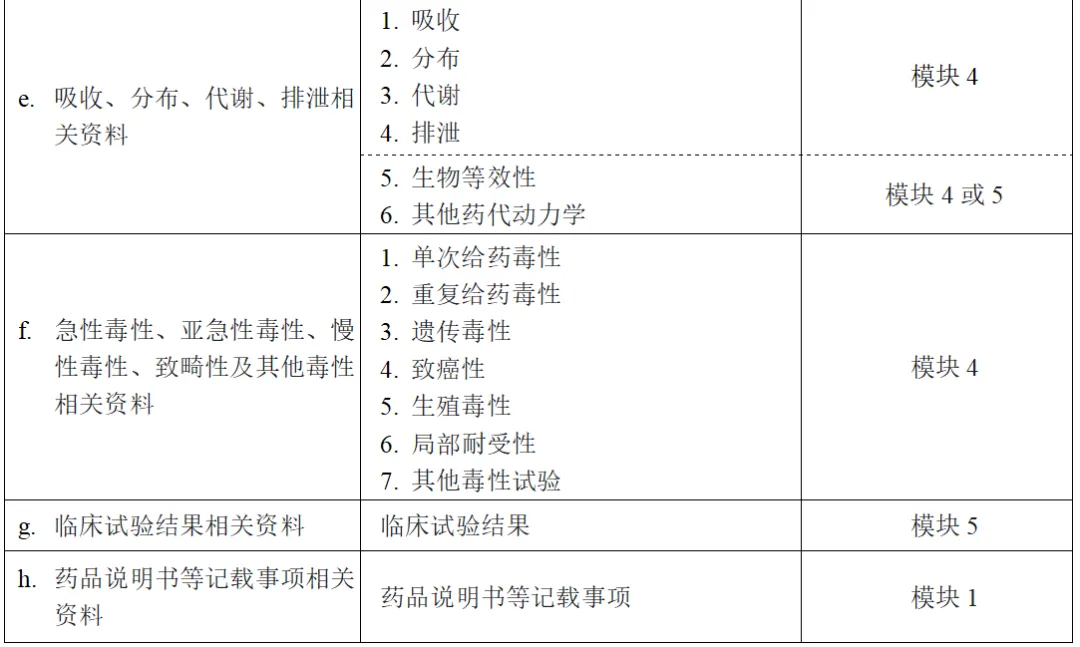
※模块1:各地区监管机构规定的注册申报时需要提交的地区特有信息。日本的模块1如下所示。
1. 模块1的目录
2.注册申请书
3.证明性文件(注册申报资料撰写负责人的陈述书、GCP、GLP相关资料、共同开发相关合同等)
4.专利信息
5.起源或发现的经过、开发经过
6.在外国的使用情况
7.同种类同功效药品一览表
8.药品说明书(草案)
9.与通用名称相关的文件
10.毒药·剧药等的指定审查资料汇总
11.上市后调查等基本计划书(草案)
12.注册申请书附带资料的一览表
13.其他
13.1 补充申请时,已批准药品的批准书、审评报告、CTD-M2等
13.2 PMDA咨询记录
13.3 PMDA问询回应(在审评结束时,应附上在该申请的从申请到批准审评过程中的问询回应)
表3 各注册分类的申报资料要求(注册申请书应附带的资料)
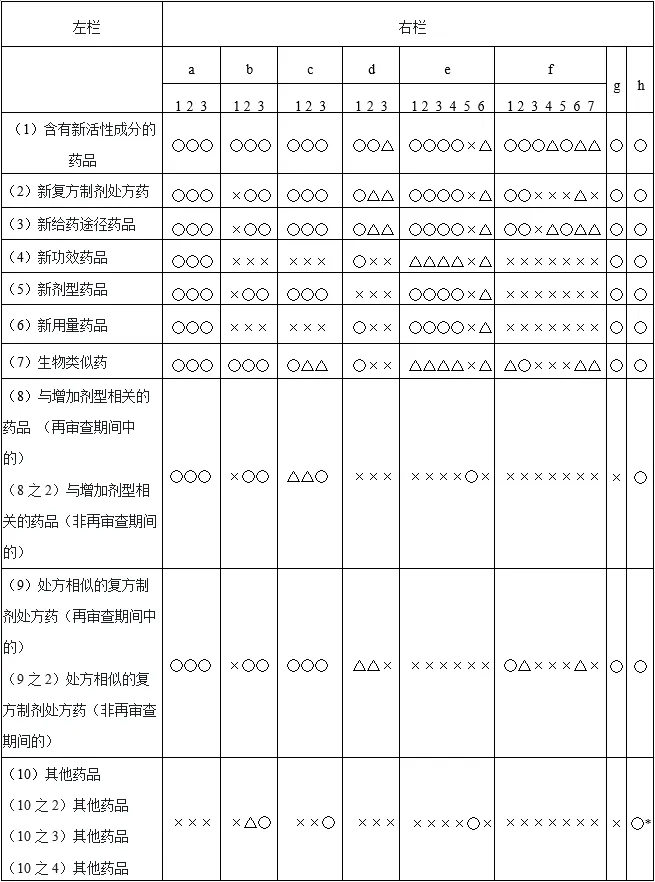
注1)右栏的符号及编号表示表2规定的资料的符号及编号,原则上,○表示需要附带,×表示不需要附带,△表示需根据各个药品的情况判断是否附带。
注2)右栏注的*,仅限于申请内容为生产方法变更或检测方法变更等、不引起药品说明书内容变更的情况,原则上,无需附带“h:药品说明书等记载事项相关资料”。
表2及表3的使用方法
① 确定拟申请药品的注册分类
② 在表3中确认按注册分类应在注册申请书附带的资料的〇项目。
③ 例如“b-1”,在注册分类(1)及(7)中是需要的,但在其他注册分类中不需要,也就可以知道,表2中对应“b-1”的“结构确证及物理和化学性质等”资料,除含有新活性成分的药品及生物类似药外是不需要的。因此,结合表2及表3,可以判断模块3中“结构确证及物理和化学性质等”资料是否需要。
笔者精选信息7
注册分类与注册收费
注册分类(1)的含有新活性成分的药品的注册申请时需支付的注册收费为36,538,400日元(折合人民币约179万元)(此外还需要符合性检查费用等。参考下表。)。另外,补充申请的新功效药品(注册分类(4))及新用量药品(注册分类(6))的注册收费分别为15,652,600日元(折合人民币约76.7万元)。
如果制药公司申请含有新活性成分的药品的注册,且在审评期间想对该药品申请增加新功效,注册分类必须为“处方药(1)含有新活性成分的药品”。此外,当先进行的(1)的注册申请获得批准时,必须先撤回为增加新功效而进行的(1)的注册申请,再重新进行增加新功效的注册申请(4)。
即,首次申请(1)时支付36,538,400日元,并在该品种审评期间补充申请新功效时,重新按照(1)的进行申请并支付(1)的注册收费36,538,400日元,首次申请获得批准后,撤回为申请新功效而提交(1)的申请(但是,已缴纳的注册收费不予退回),支付(4)的15,652,600日元。为了控制该费用,若在最初的含有新活性成分的药品的申请(1)获得批准后再申请增加新功效,(4)的申请只需支付15,652,600日元。但是,为此,即使制药公司的新功效的数据已经齐全,也必须等待数月直至(1)的审评结束。因此,对于制药公司来说,是不等待(1)的批准,而为了尽早获得审评期间增加的新功效的批准而支付双重(两次(1))注册收费,还是选择等待,这是非常令人纠结的事情。
值得一提的是,(1)的获得批准后,以新功效及新用量进行补充申请时,注册分类为(4)及(6),但注册收费不是(4)和(6)的合计,而是支付金额较高的一方(在这种情况下金额相同,所以只需支付(4)的费用)。另外,申请已批准药品的缓慢释放制剂时,若分类仅为(5)新剂型药品,注册收费为323,000日元(折合人民币约1.58万元),但实际上还伴随新用量(6)的申请,因此费用本身应为(6)的收费金额。由于注册收费的计算如此复杂,所以需要事先向PMDA审查业务部业务第一科确认。
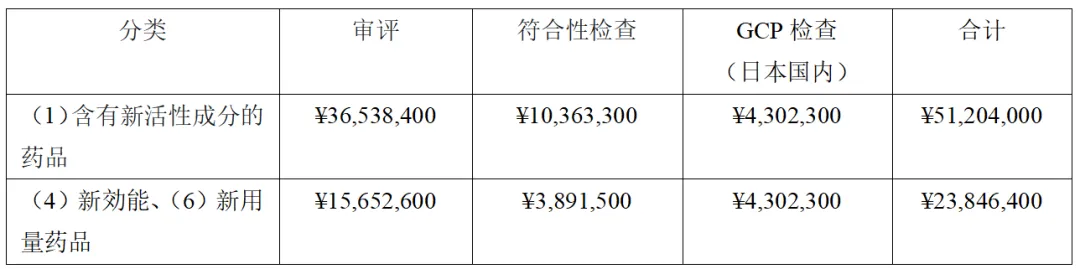
※还需要考虑可能产生的GMP符合性检查费用。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 636
636

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 645
645

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 614
614