 产业资讯
产业资讯
 企业公告
企业公告  2018-07-20
2018-07-20
 6394
6394
近日,上海市药监局收到国家药监局下发的品种批件,近期上海市共有18个品规通过CFDA审批获准上市,包括第一三共、和记黄埔和恒瑞等企业。值得注意的是,上海安必生制药作为主送单位的孟鲁司特钠咀嚼片有两个规格(4mg和5mg)获得审批。
据公开资料显示,安必生研发的孟鲁司特钠咀嚼片(4mg和5mg两个规格,批准文号:ANDA205695)在2015年11月已获得美国FDA审批,另外孟鲁司特钠普通片(批准文号:ANDA#205683)在2016年1月获FDA审批。
孟鲁司特钠咀嚼片(4mg和5mg)于2016年12月获CDE以“国外已上市同步申请国内上市的仿制药”的理由纳入第十二批优先审评名单,在2018年6月28日获批,成为第一个在中国和美国两个市场同时上市的孟鲁司特钠咀嚼片产品,
同时与美国市场销售的孟鲁司特咀嚼片为共线生产,同处方工艺生产,视同通过一致性评价,成为首个通过一致性评价的孟鲁司特钠产品,享受与原研品“顺尔宁”(研发厂家:默沙东)的同等待遇。
据IPM数据显示,孟鲁司特钠制剂2017年国内市场总规模为17.5亿元,默沙东占比69%,鲁南贝特和四川大冢基本持平,分别占16%和15%。
在剂型上,成人使用的片剂约占一半,而儿童患者作为哮喘的高发人群,其专用剂型咀嚼片(4mg)占比在40%以上;而4mg咀嚼片先前为默沙东独有的剂型规格,随着安必生的两个品规获批并视同通过一致性评价,预计默沙东的领先地位将收到有力冲击。
然而,首个通过仿制药一致性评价的孟鲁司特钠产品并非是安必生此番获批唯一的亮点,“国内首家药品研发机构持有药品上市许可”更是其不可忽略的闪光之处。
2015年8月18日,国务院颁发《国务院关于改革药品医疗器械审评审批制度的意见》国发〔2015〕44号,明确指出开展药品上市许可持有人制度试点:允许药品研发机构和科研人员申请注册新药,试点工作在依照法定程序取得授权后开展。
2016年10月25日,上海市药监局发布《关于上海市已申请参加药品上市许可持有人制度改革试点品种名单的公告》,名单包括9家药物研发机构、11家药品生产企业、12个品种。
而安必生作为申请人和持有人,其委托杭州民生滨江制药生产的孟鲁司特钠制剂被纳入首批名单之列。
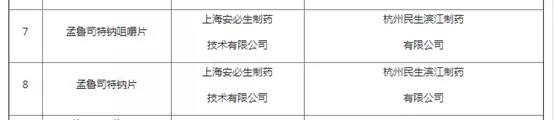
(图片来源:上海市药监局)
而在6月28日,距离纳入MAH名单不够两年的时间,安必生作为上市许可持有人的孟鲁司特钠咀嚼片已成功获得CFDA上市审批,成为首家国内首家持有药品上市许可的药品研发机构,产品上市时间得到提速,这正是国家大力推行药物MAH的初衷。
在去年8月21日,国家药监总局发布《关于推进药品上市许可持有人制度试点工作有关事项的通知》,再次对北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川10个上市许可持有人制度(MAH)试点省(市)的工作作出具体要求
其中包括:落实持有人法律责任(药品全生命周期管理)、促进专业化规模化生产、允许持有人多点委托生产、允许持有人自行或委托销售药品、完善两地药品监管责任(持有人和生产企业异地)以及积极探索试点模式等工作。
药品MAH制度实施的重点意义在于释放药企的生产力,药品批文和生产企业得以“松绑”,对药物的创新研发、药品的保障供应和整个医药产业链的健康发展起到结构性的积极影响,同时能够遏制国内现时低水平复制的行业模式,对研发机构、科研人员以及生产企业的研发生产动力和热情得到激发。
同时,随着MAH的进一步落实推广,医药产业链各个环节的分工将趋向专业化,行业各领域划分将更加精细,或致使医药行业向轻资产运营模式发展。
MAH制度推动三大医药外包服务快速发展
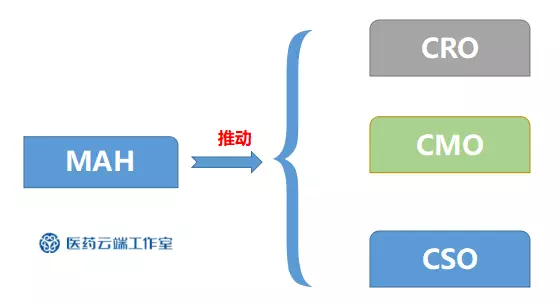
关于上海安必生制药
上海安必生制药技术有限公司成立于2007年10月,是一家由国内外数十位科学家和技术专家共同投资组建的制药技术高科技企业。公司董事总经理雷继峰在多家国内和跨国制药公司工作20余年,从事生产、工艺、工程以及管理等工作。
安必生公司致力于仿制药的开发研究及其在美国和欧盟的注册,FDA等机构的CGMP认证服务,旨在帮助国内制药企业走向国际市场。
同时,该企业拥有一批曾就职于FDA和EMEA的专家和在国内外创新药公司和仿制药公司工作过的科学家和技术人员,对FDA和EMEA的机构、人员、职能、法规、技术要求有全面系统的认识和掌握。
2012年开始,安必生CEO雷继峰和百洋医药集团合作,合资创建青岛百洋制药。以缓控释技术药品研发和生产为特色,面向中国和海外法规市场,致力于建设仿制药制剂的国际化制造平台。目前已陆续研发和申报多项高端ANDA产品。
百洋制药于2016年10月零缺陷通过了美国FDA的cGMP现场检查,据相关负责人介绍,百洋制药的盐酸安非他酮缓释片获得FDA批准以后,将继续申请国内MAH。
在2017年6月20日,以上海安必生制药15%股权,引入浙江永太科技3375万元的战略增资。随着其合作企业的安非他酮缓释片的成功上市,安必生制药也在MAH制度的利好下获得快速发展。

 产业资讯
产业资讯
 谈思生物
谈思生物  2025-11-25
2025-11-25
 9
9

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-11-25
2025-11-25
 8
8

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-25
2025-11-25
 9
9