 会员动态
会员动态
 2018-12-03
2018-12-03
 7586
7586
一.罗沙司他,近期将获批上市。药融数据,Pharnex Datamonitor。

| 受理号 | CXHS1800013国 |
| 企业名称 | 珐博进(中国)医药技术开发有限公司 |
| 办理状态 | 在审评审批中(在药审中心) |
| 状态开始时间 | 2018-6-28 11:17:50 |
| 通知时间 | 无 |
| 标准品回执收到日 | 不需要 |
| 收费情况 | 不收费 |
| 费用收到日 |
|
| 检验报告收到日 | 未提交 |
| 药品批准文号 |
|
| 通知内容 | 无 |
本专业已完成审评
|
序号
|
受理号
|
药品名称
|
进入中心时间
|
审评状态
|
药理毒理
|
临床
|
药学
|
备注
|
|
27
|
CXHS1800013
|
罗沙司他胶囊
|
2018-06-29
|
排队待审评
|
|
|
|
|
|
28
|
CXHS1800014
|
罗沙司他胶囊
|
2018-06-29
|
排队待审评
|
|
|
|
|
二.中国有望成为全球首创药的首个上市国家
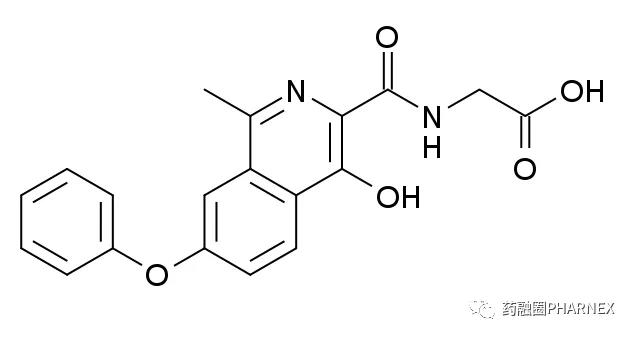
罗沙司他(Roxadustat)是用于治疗肾性贫血的首个口服小分子 HIF-PHI,能够在氧分压正常的情况下抑制 HIF-脯氨酰羟化酶,稳定 HIF-α,促内源性 EPO 生成及改善铁吸收利用,综合调控促进红细胞生成。在中国所进行的治疗透析依赖(DD-CKD)和非透析依赖(NDD-CKD)的慢性肾病患者贫血状况的两项III期临床试验结果均达到了主要有效终点。
CKD 透析患者研究结果
26 周初始治疗期内,最后5周平均 Hb 水平较基线的改变显示,罗沙司他组达到非劣效性主要终点,且优效性分析表明,罗沙司他组平均 Hb 增加明显高于 EPOα 组(0.75 g/dL vs 0.46 g/dL,p = 0.037,PPS 人群分析)。
CKD 非透析患者研究结果
第8周末,罗沙司他组达到主要终点,Hb 水平较基线的改变明显优于安慰剂组(1.9 g/dL vs -0.4 g/dL,p<10-15),达到 Hb 反应(较基线增加 ≥ 1 g/dL)的患者比例也明显高于安慰剂组(84.2% vs 0.0%,p<10-15)。
2017年12月18日,罗沙司他被CDE以“与现有治疗手段相比具有明显治疗优势”纳入优先审评,中国上市后的商业推广工作由阿斯利康负责。
补充:
可博美胶囊(FG-4592胶囊),在国内开展过一项:比较珐博进(中国)生产的可博美胶囊与上海药明康德生产的可博美胶囊的生物利用度和生物等效性临床试验。笔者猜测可能是临床开发是采用药明的制剂CMO服务,后期转移到自身工厂。
目前在国内招募的临床有:FG-4592治疗相对低危的骨髓增生异常综合征患者贫血的II期/III期试验,PI为中国医学科学院血液病研究所肖志坚教授。
 会员动态
会员动态
 新康界
新康界  2025-05-02
2025-05-02
 125
125

 会员动态
会员动态
 信达生物
信达生物  2025-04-29
2025-04-29
 200
200

 会员动态
会员动态
 医药笔记
医药笔记  2025-04-26
2025-04-26
 167
167