绿叶制药(Luye Pharma)合作伙伴PharmaMar是一家在发现和开发创新型海洋衍生抗癌药方面的全球领先生物制药公司。近日,PharmaMar公司宣布,美国食品和药物管理局(FDA)已受理lurbinectedin(Zepsyre®)的新药申请(NDA)并授予了优先审查。该NDA寻求加速批准lurbinectedin,用于治疗经过铂基化疗后疾病进展的小细胞肺癌(SCLC)患者。
FDA已将处方药用户收费法(PDUFA)目标日期定为2020年8月16日。
在美国,PharmaMar与Jazz Pharmaceuticals于2019年12月签订了独家许可协议,该协议于2020年1月生效,授予了Jazz公司在美国市场商业化lurbinectedin的权利。
lurbinectedin(Zepsyre®)是西班牙生物制药公司PharmaMar研发的海鞘素衍生物,为
肿瘤创新药。目前,绿叶制药与PharmaMar在华合作共同开发该药物。绿叶制药拥有该药物在中国开发及商业化的独家权利,包括小细胞肺癌在内的所有适应症;并可要求PharmarMar进行该药物的技术转移,由绿叶制药在中国生产。
此次NDA基于lurbinectedin(Zepsyre®)治疗小细胞肺癌的II期单药治疗篮式研究数据。该试验共入组105名患者,试验结果表明,
lurbinectedin(Zepsyre®)作为单药疗法,
二线单药治疗小细胞肺癌的总有效率(ORR)达到35.2%,中位总生存期(OS)为9.3个月。根据研究者评估和独立评审委员会(Independent Review Committee)的评估结果,该试验达到总有效率(ORR)的主要终点。
lurbinectedin(Zepsyre®)在敏感性复发的患者中(停疗间隔≥90天)的效果更好,ORR为45%,OS为11.9个月。lurbinectedin(Zepsyre®)在耐药复发的患者中(停疗间隔<90天)表现出的活性,其ORR为22.2%,OS为5个月,对于这一类患者,目前市场上尚无获批药物。lurbinectedin(Zepsyre®)具有良好、可控的安全性。该研究结果也已在今年6月的美国临床
肿瘤学会(ASCO)大会上发布。
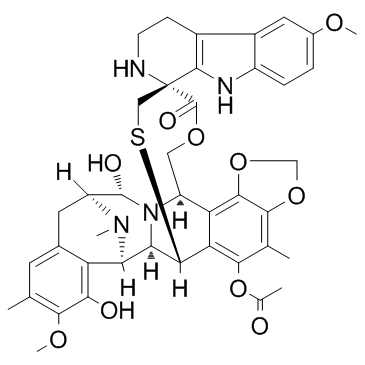
Lurbinectedin分子结构式(图片来源:medchemexpress.com)
Lurbinectedin(Zepsyre®)是海鞘素衍生物,为RNA聚合酶II的抑制剂,能够与DNA双螺旋结构上的小沟共价结合,通过阻滞RNA聚合酶II与DNA的结合,并降解RNA聚合酶II的催化亚基RPB1,从转录的起始至延长阶段发挥抑制转录活性,使
肿瘤细胞在有丝分裂过程中畸变、凋亡、最终减少细胞增殖。
小细胞肺癌占全部肺癌患者的10%-15%左右,是比非小细胞肺癌侵袭性更强、更难治疗的一种肺癌类型,5年生存率仅为5%-10%。尽管小细胞肺癌对初始化疗和放疗具有较高的敏感性,但在初始治疗失败后,大多数患者最终死于复发转移,预后差。
根据PharmaMar去年12月发布的公告,小细胞肺癌的新药进展缓慢,该领域在过去20多年来尚未出现实质性变化,1996年获批治疗复发性小细胞肺癌的药物拓扑替康(topoteean,Hycamtin)是美国
FDA在过去20多年来批准的最后一个新化学实体。如果获得批准,Lurbinectedin(Zepsyre®)将成为过去20多年来治疗小细胞肺癌的首个新化学实体。
不过,根据国外生物技术网站FierceBiotech的报道,PharmaMar对小细胞肺癌药物创新方面的描述存在错误。近年来,百时美施贵宝和默沙东的2款PD-1
肿瘤免疫疗法Opdivo(中文商品名:欧狄沃,通用名:nivolumab,纳武利尤单抗)和Keytruda(中文商品名:可瑞达,通用名:pembrolizumab,帕博利珠单抗)分别获得了美国
FDA批准,用于治疗:接受含铂化疗和至少一种其他疗法后病情进展的小细胞肺癌患者。
因此,小细胞肺癌患者可以选择接受检查点抑制剂治疗。不过,Opdivo和Keytruda治疗小细胞肺癌的总缓解率低于Lurbinectedin(Zepsyre®)达到的35%。尽管交叉试验比较的不可靠性使得这种差异的意义不明确。但PharmaMar公司也有早期证据表明,Lurbinectedin(Zepsyre®)对先前接受过免疫
肿瘤学疗法治疗的患者也有效。
绿叶制药此前表示,希望通过与PharmaMar的合作进一步拓展自身在肿瘤领域的研发产品线,也希望通过该创新药为广大中国医生和患者提供新的治疗选择。
肿瘤领域是绿叶制药聚焦的核心治疗领域之一,公司凭借自主研发与合作研发的方式,深度布局该治疗领域的全球产品线,目前已有十余个创新制剂和创新药,分别在中国和海外处于不同临床阶段。
 产业资讯
产业资讯
 生物谷
生物谷  2020-02-18
2020-02-18
 3830
3830

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-07
2025-05-07
 29
29

 产业资讯
产业资讯
 研发客
研发客  2025-05-07
2025-05-07
 29
29

 产业资讯
产业资讯
 药渡
药渡  2025-05-07
2025-05-07
 30
30