 会员动态
会员动态
 Insight数据库
Insight数据库  2021-11-01
2021-11-01
 3565
3565
10 月 29 日,百济神州登记启动了 HER2 双抗 Zanidatamab(研发代号:ZW25)的 3 期临床,针对不可切除的局部晚期或转移性 HER2 阳性胃食管腺癌(GEA)。这是首个进入 3 期临床阶段的 HER2 双抗。
这是一项随机、开放全球多中心 3 期临床,旨在比较 Zanidatamab 联合化疗、联合或不联合替雷利珠单抗与曲妥珠单抗联合化疗的疗效。试验的主要研究者为北京肿瘤医院的沈琳教授,主要终点为 BICR 根据 RECIST1.1 评估的 PFS 和 OS,国内计划招募 230 人,全球计划招募 1149 人。
来自:CDE 临床试验登记与公示平台
目前,据 Insight 数据库,全球范围内尚无其他 HER2 双抗进入 3 期临床。不过康宁杰瑞也已经在 10 月 21 日递交了其 HER2 双抗 KN026 二线治疗胃及胃食管结合部腺癌 3 期注册临床的临床试验申请。
引进自 Zymeworks,2 期数据亮眼
ZW25 是 Zymeworks 基于其 Azymetric™ 平台开发的双特异性抗体,可以同时结合两个非重叠的 HER2 表位(亚基 2 和亚基 4),即双互补位结合。此种设计既可双重阻断 HER2 信号、增强结合并去除细胞表面的 HER2 蛋白,同时具有强有力的抗体效应子功能,增进其抗肿瘤活性。目前,该药已获美国 FDA 授予针对胃癌、卵巢癌的孤儿药资格和联合化疗一线治疗 HER2 阳性胃食管腺癌患者的快速通道资格。
百济神州在 2018 年 11 月 27 日以 4000 万美元首付款+至多 3.9 亿美元临床开发及商业化里程碑付款获得了 ZW25 和另一款 ADC ZW49 在亚洲(日本除外)、澳大利亚和新西兰的开发和商业化的独家授权。除了这两款药物之外,百济还与 Zymeworks 达成针对其双抗平台的合作。
在 2021 ESMO 上,Zymeworks 公布了 ZW25 联合化疗药物一线治疗 HER2 阳性胃食管腺癌 2 期临床(ZWI-ZW25-201)的亮眼数据。研究结果显示,在纳入的 36 名患者中,接受联合疗法的患者经确认的总客观缓解率(cORR)达到 75%,疾病控制率(DCR)89%,中位无进展生存期(mPFS)为 12 个月,中位缓解持续时间(mDOR)为 16.4 个月。尤其在 ZW25 + CAPOX/FP 组,ORR 更是达到了 92%/100%。
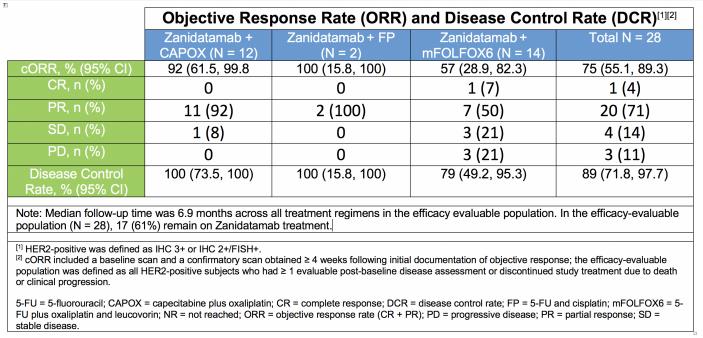
来自:ESMO 2021
HER2 阳性胃癌约占所有胃癌的 20%,既往 HER2 阳性胃癌标准一线治疗为曲妥珠单抗联合化疗,中位总生存期(OS)为 13.8 个月,无进展生存期(PFS)为 6.7 个月,ORR 为 47%。
ZW25 的 2 期临床数据首次证明了 HER2 双抗在 HER2 阳性晚期胃癌领域的治疗优势,有望为相应患者群体带来更多获益。如今,这款产品终于进入 3 期临床。
康宁杰瑞/石药紧随其后
据 Insight 数据库显示,目前国内的 HER2 双抗共 3 款被推进到临床阶段。康宁杰瑞/石药集团的 HER2 双抗 KN026 进度飞快,也已经提交 3 期临床申请(点此监控)。这款双抗同样结合 HER2 的 D2 亚基和 D4 亚基,除注射剂外,KN026 还获批以液体制剂开展临床试验,有望提供更加便利的给药方式,并为开发皮下注射制剂奠定基础。
在 2021 年 ASCO 年会上,康宁杰瑞发布了 KN026 的胃癌 II 期临床数据。结果显示,在 HER2 高表达患者中,客观缓解率(ORR)为 55.6%,疾病控制率(DCR)为 72.2%,9 个月无进展生存率为 60.4%;既往接受过曲妥珠治疗的患者客观缓解率(ORR)为 44.4%、疾病控制率(DCR)为 66.7%。
今年 8 月,石药集团子公司津曼特生物以 1.5 亿元预付款 +4.5 亿元开发里程碑 +4 亿元销售里程碑获得了康宁杰瑞 KN26 单药及联合 PD-L1/CTLA-4 双抗 KN046 在中国内地治疗乳腺癌及胃癌的独家权益。
除此之外,国内天广实的 MBS301 也已经进入 I 期临床阶段。这是一款 ADCC 增强型抗 HER2 双表位双特异性抗体。

 会员动态
会员动态
 信达生物
信达生物  2025-04-29
2025-04-29
 68
68

 会员动态
会员动态
 医药笔记
医药笔记  2025-04-26
2025-04-26
 101
101

 会员动态
会员动态
 医药观澜
医药观澜  2025-04-24
2025-04-24
 104
104