 产业资讯
产业资讯
 米内网
米内网  2021-12-06
2021-12-06
 2396
2396
摘要
abstract
11月CDE共承办药品注册申请1018件
7个存量品种首次有企业申报一致性评价
4个1类新药报产,10个双抗药物报临床
仿制申请中有27个品种暂无国产获批
6个1类创新药获批,其中4款为1.1类中药创新药
3个首仿品种获批,7个存量品种迎首家过评
CDE总体承办情况
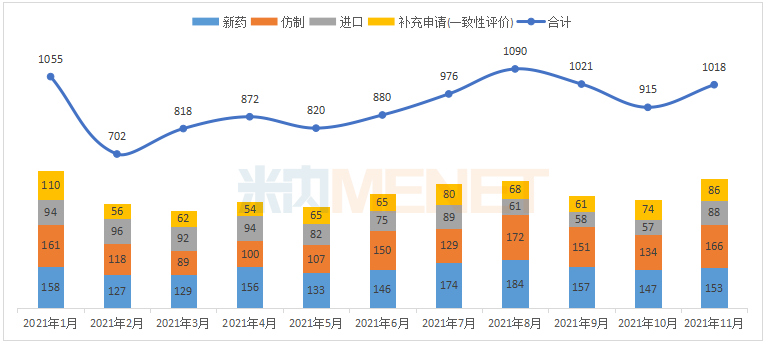
据米内网MED2.0中国药品审评数据库统计,2021年11月CDE共承办药品注册申请1018件。
2021年1月-11月CDE承办药品注册申请情况(按受理号计)
一致性评价补充申请承办情况
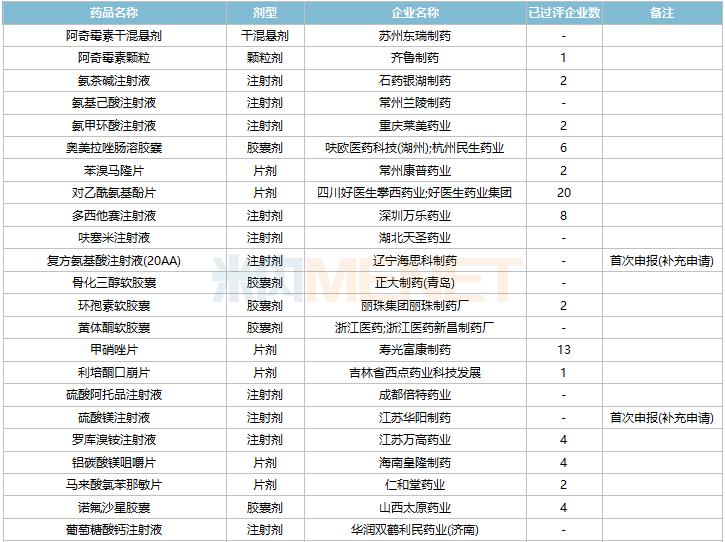
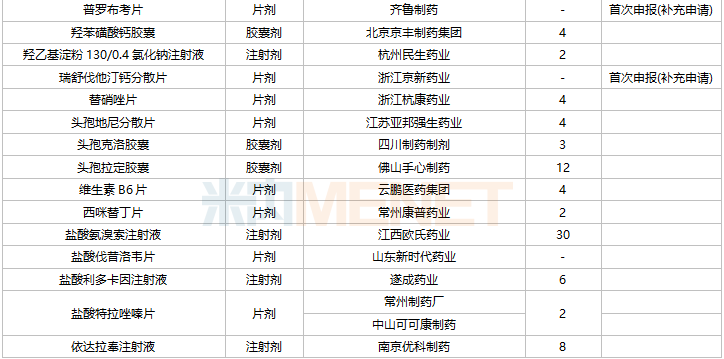
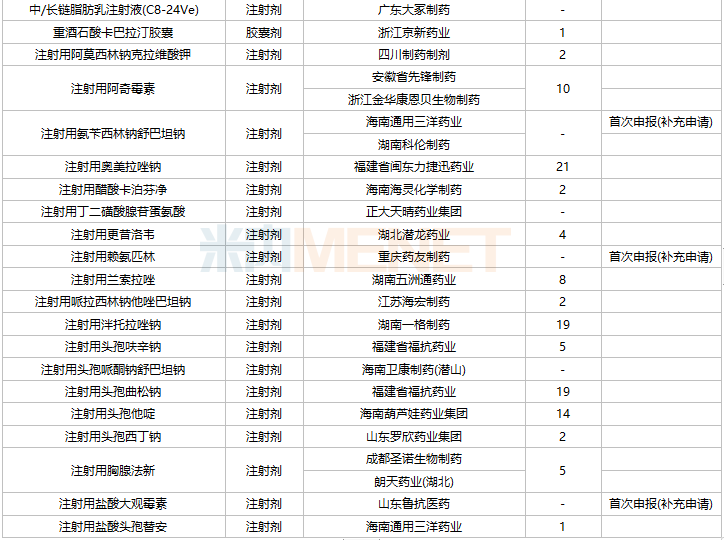
2021年11月,59个品种的一致性评价补充申请获CDE承办。7个品种为首次提交一致性评价补充申请:复方氨基酸注射液(20AA)、硫酸镁注射液、普罗布考片、瑞舒伐他汀钙分散片、注射用氨苄西林钠舒巴坦钠、注射用赖氨匹林、注射用盐酸大观霉素。详细情况见下表:
11月CDE补充申请(一致性评价)品种承办情况
新药申请承办情况
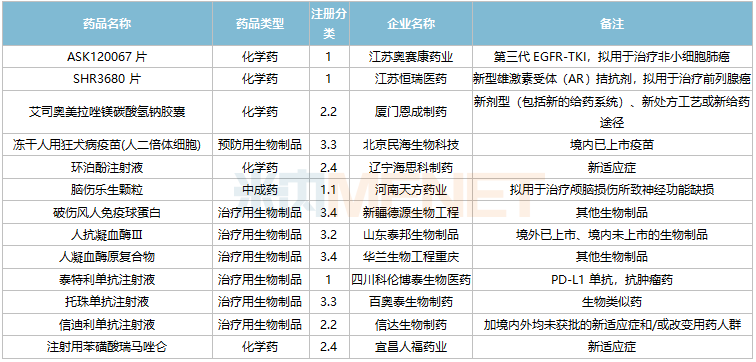
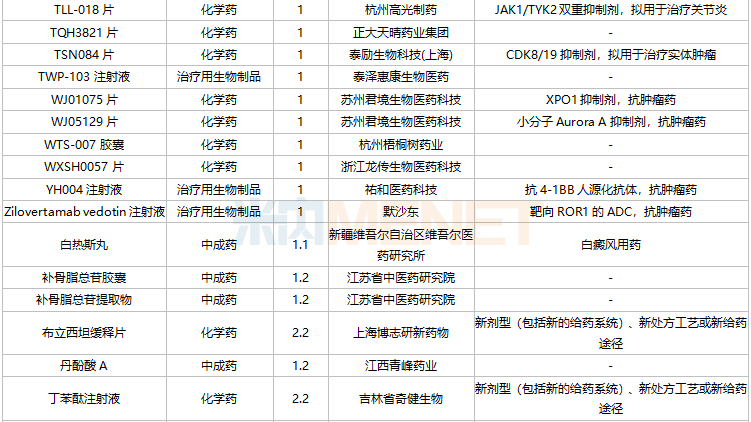
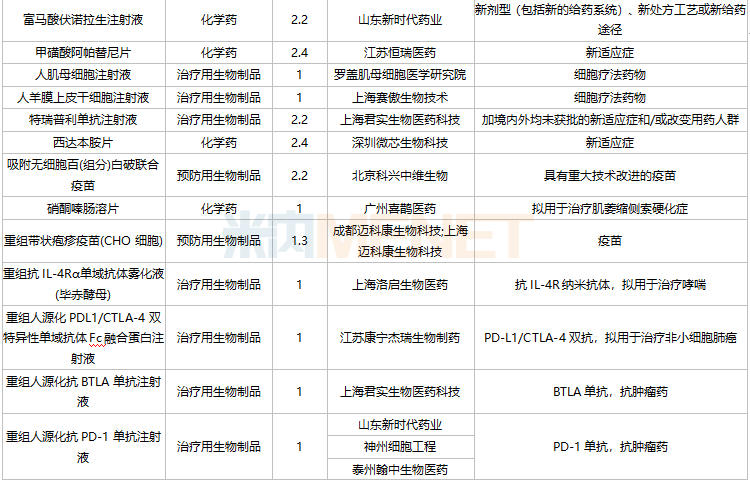
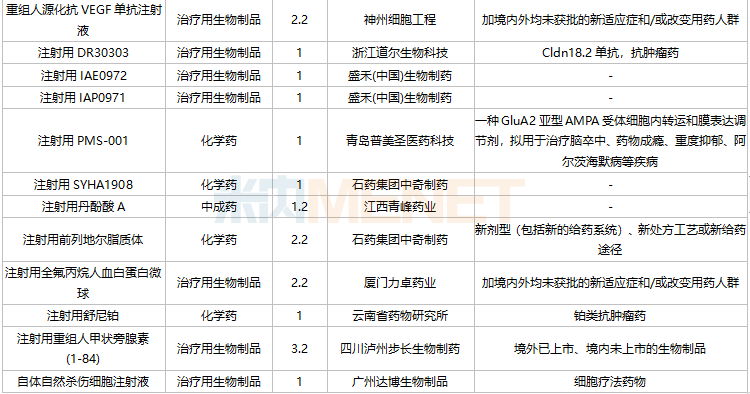
2021年11月,105个品种的新药申请获CDE承办。其中1类新药有79个,2类改良型新药有17个,3.3类生物类似药2个。
江苏奥赛康药业、江苏恒瑞医药、河南天方药业以及四川科伦博泰生物均有一款1类新药申报上市。辽宁海思科制药的环泊酚注射液有新适应症上市申请。
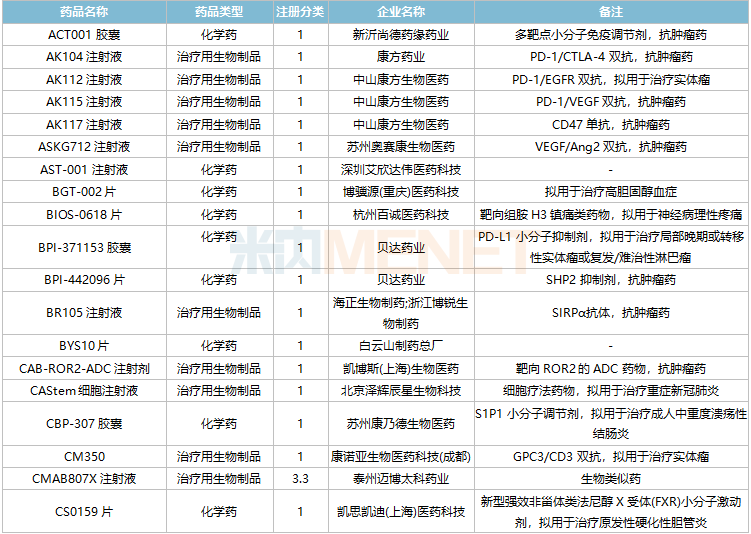
此外,11月双特异性抗体药物申报活跃,HLX35、ASKG712注射液、AK112注射液、AK104注射液、CM350、AK115注射液、PM1022注射液、KN052注射液、SI-B003双特异性抗体注射液、重组人源化PD-L1/CTLA-4双特异性单域抗体Fc融合蛋白注射液等10个品种均为双特异性抗体药物。
11月国内新药上市申请承办情况
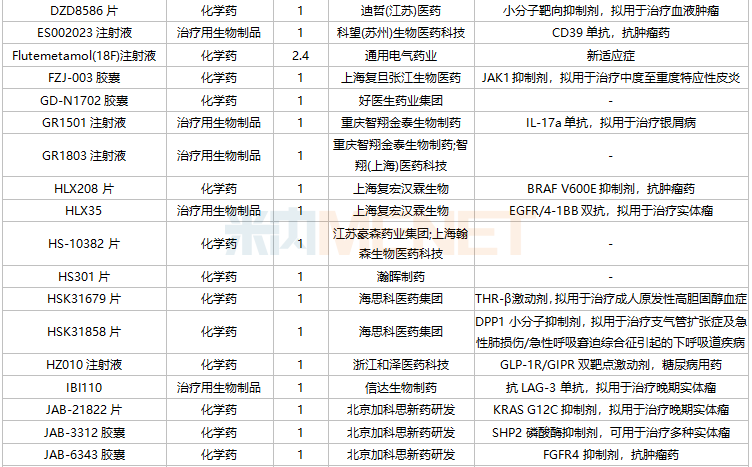
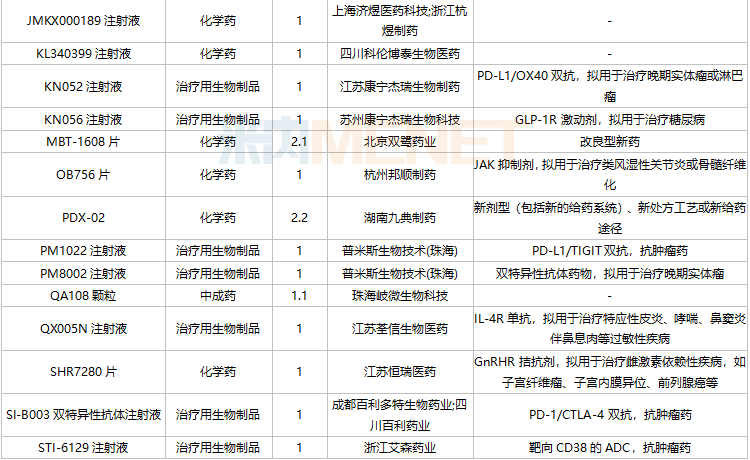
11月国内新药临床申请承办情况
仿制申请承办情况
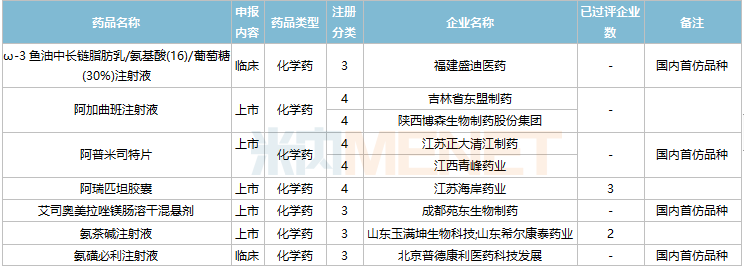
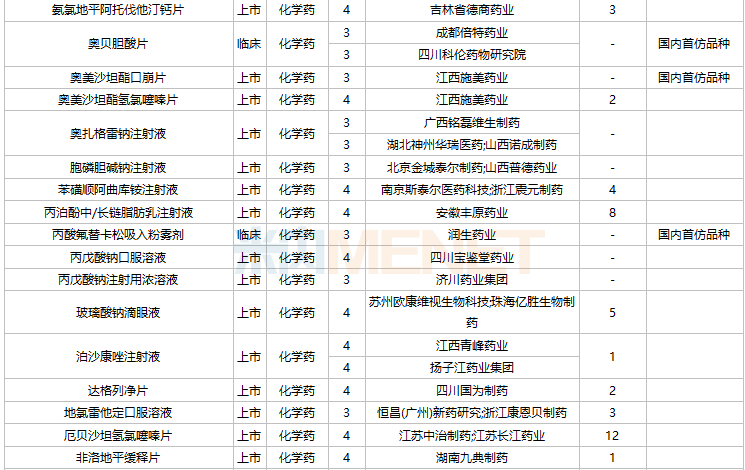
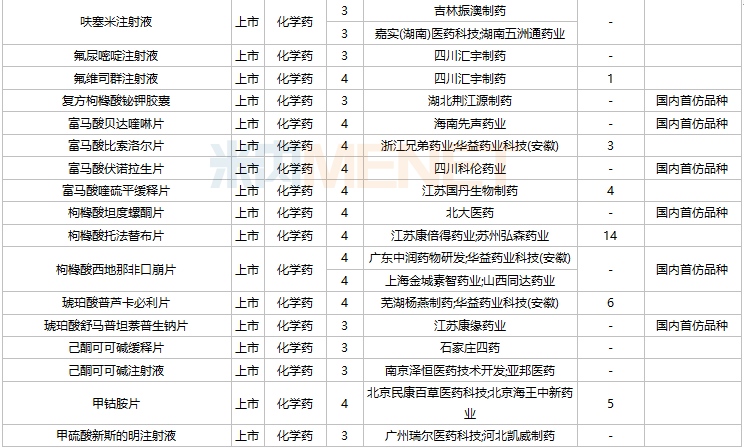
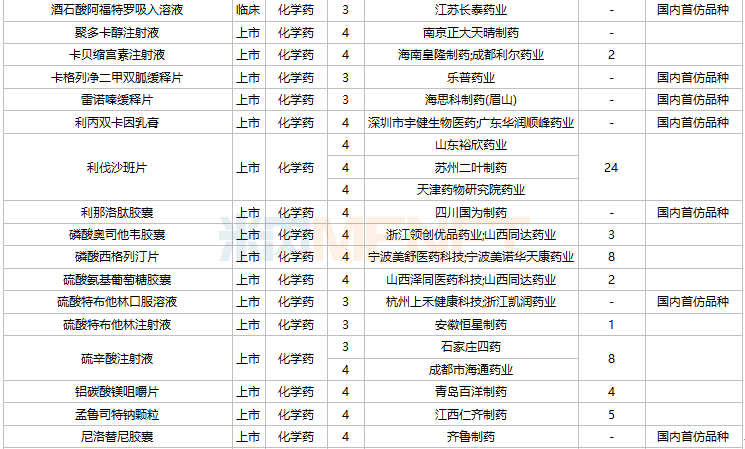
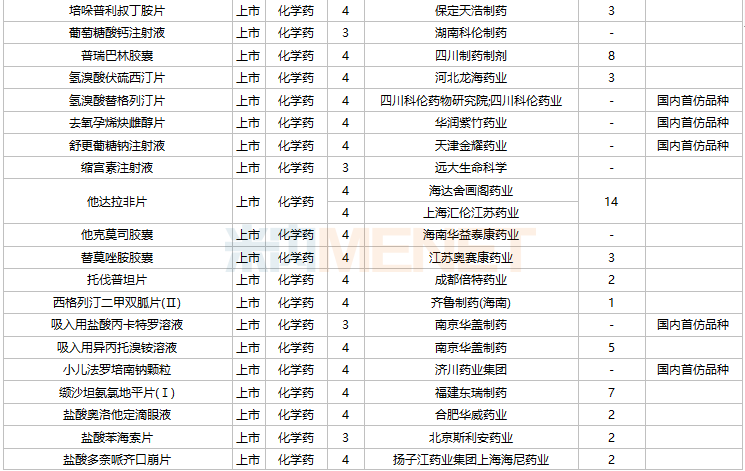
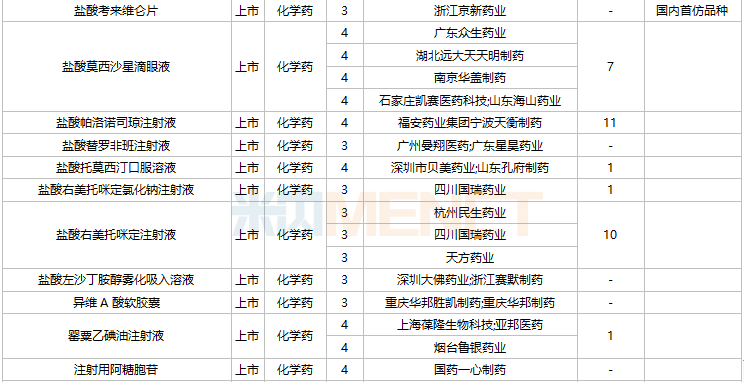
2021年11月,104个品种的仿制申请获CDE承办,其中27个品种暂无国产获批:ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液、阿普米司特片、艾司奥美拉唑镁肠溶干混悬剂、氨磺必利注射液、奥贝胆酸片、奥美沙坦酯口崩片、丙酸氟替卡松吸入粉雾剂、复方枸橼酸铋钾胶囊、富马酸贝达喹啉片、富马酸伏诺拉生片、枸橼酸坦度螺酮片、枸橼酸西地那非口崩片、琥珀酸舒马普坦萘普生钠片、酒石酸阿福特罗吸入溶液、卡格列净二甲双胍缓释片、雷诺嗪缓释片、利丙双卡因乳膏、利那洛肽胶囊、硫酸特布他林口服溶液、尼洛替尼胶囊、氢溴酸替格列汀片、去氧孕烯炔雌醇片、舒更葡糖钠注射液、吸入用盐酸丙卡特罗溶液、小儿法罗培南钠颗粒、盐酸考来维仑片、注射用双羟萘酸奥氮平。详细情况见下表:
11月国内仿制申请承办情况
进口申请承办情况
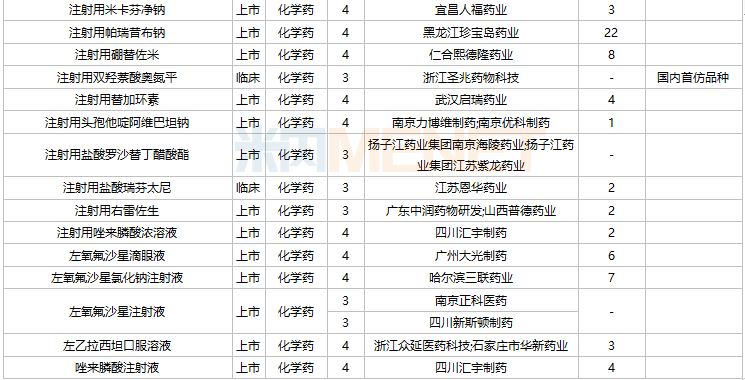
2021年11月,58个品种的进口申请获CDE承办。其中1类新药有22个,2类改良型新药有12个,5.1类进口原研药有15个,5.2类进口仿制药有5个。
11月进口上市申请承办情况
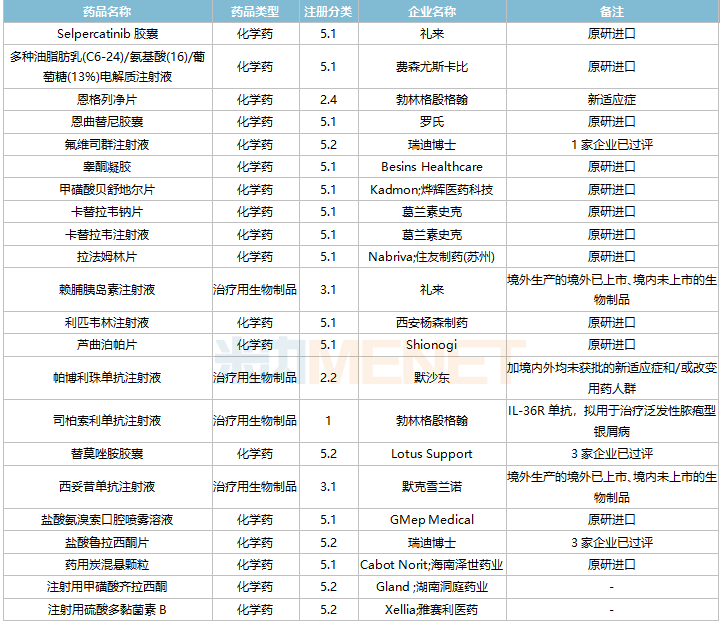
11月进口临床申请承办情况
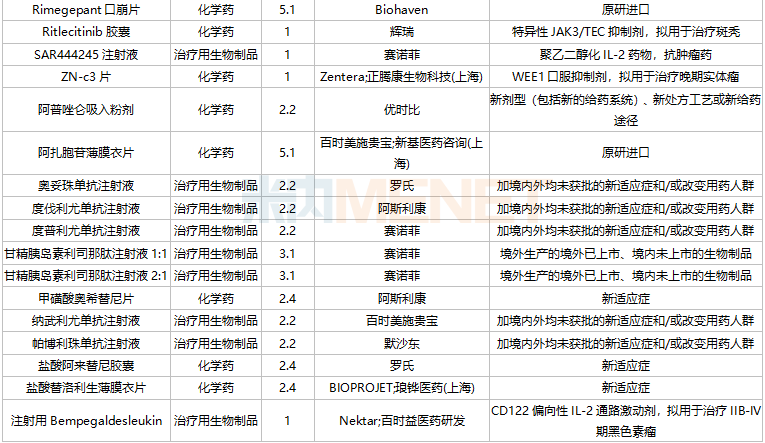

获批情况
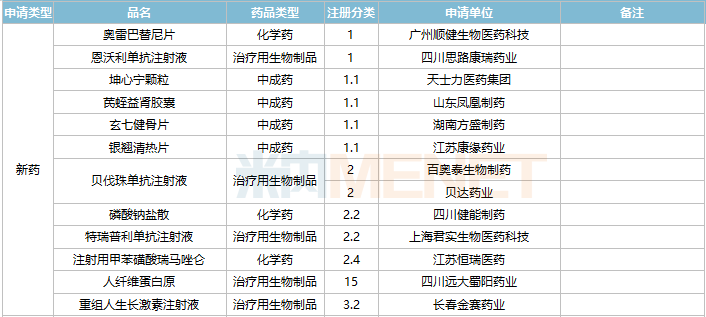
2021年11月,广州顺健生物医药科技的1类新药奥雷巴替尼片以及四川思路康瑞药业的1类新药恩沃利单抗注射液获批上市,此外还有四款中成药1.1类新药获批:坤心宁颗粒、芪蛭益肾胶囊、玄七健骨片、银翘清热片。
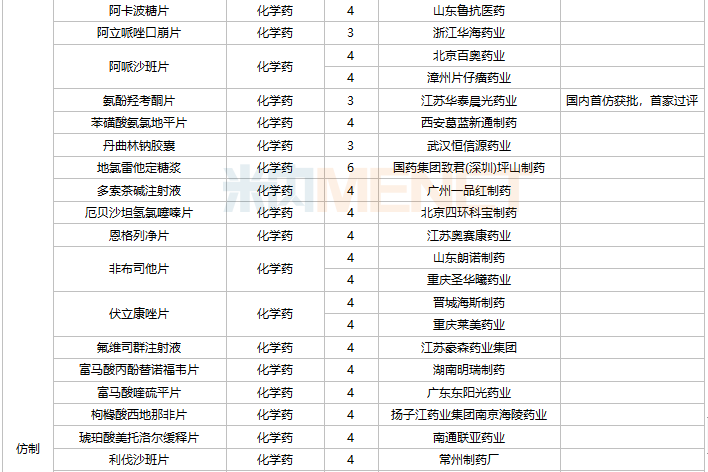
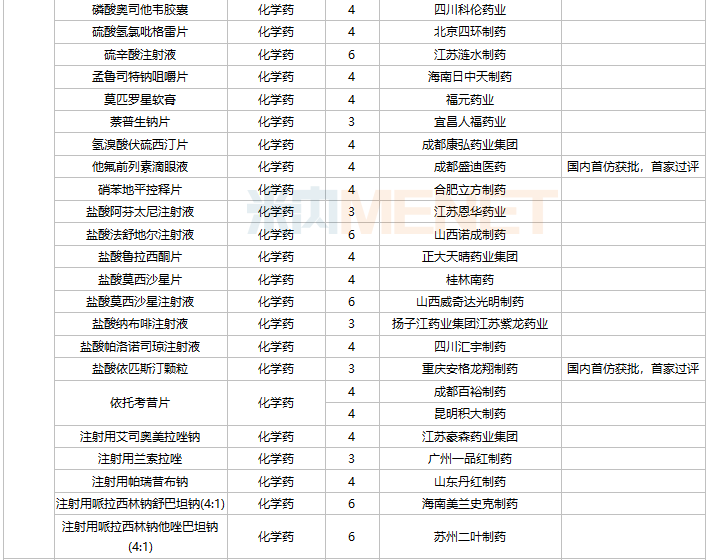
42个仿制药获批(含进口5.2类),氨酚羟考酮片、他氟前列素滴眼液、盐酸依匹斯汀颗粒等品种为国内首仿获批。61个存量品种有企业通过一致性评价,其中7个品种首次有企业过评。
11月上市申请品种及一致性评价品种获批情况
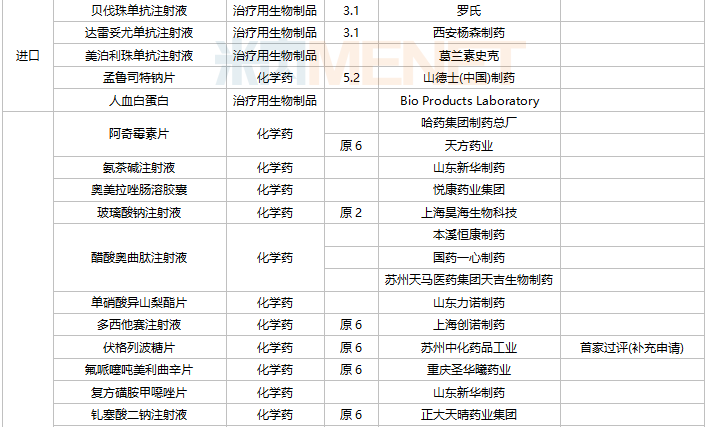
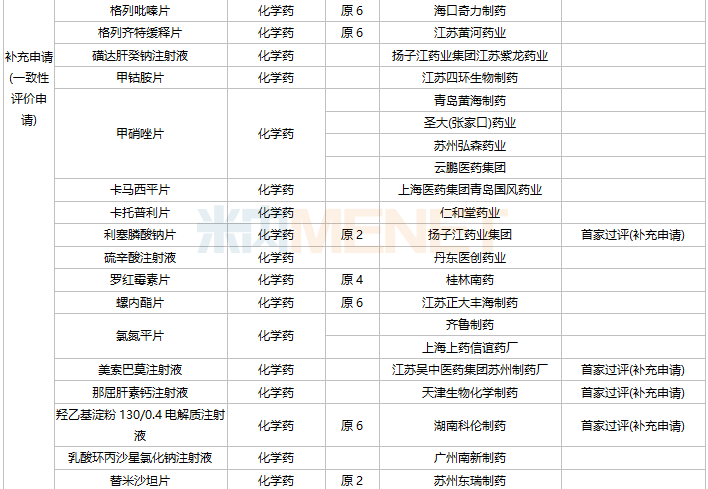
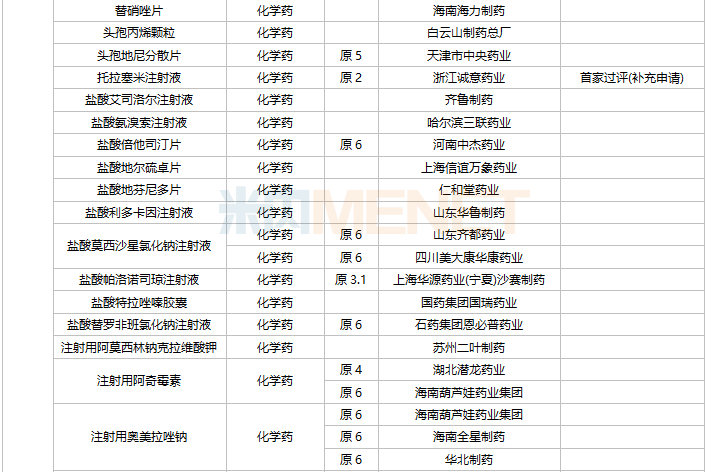
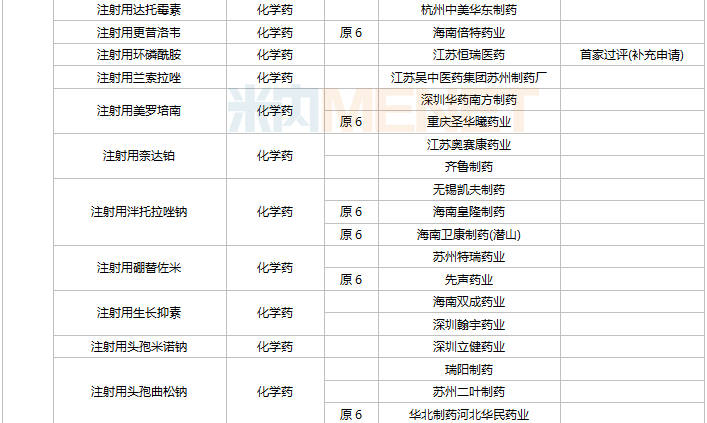
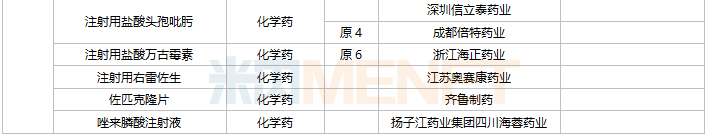
数据来源:米内网MED2.0药品审评数据库、CDE、NMPA;相关统计字段按药品名称统计,时间截至2021年11月30日;药物作用靶点以及适应症整理自公开资料。

 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-07-17
2025-07-17
 42
42

 产业资讯
产业资讯
 bioSeedin柏思荟
bioSeedin柏思荟  2025-07-17
2025-07-17
 35
35

 产业资讯
产业资讯
 动脉网
动脉网  2025-07-17
2025-07-17
 40
40