 产业资讯
产业资讯
 研发客
研发客  2021-12-14
2021-12-14
 3489
3489
近期,信达生物从UNION therapeutics引进了一款针对中重度特应性皮炎的在研药物orismilast,该产品属于PDE4抑制剂,由利奥制药(LEO Pharma)首先开发并于2020年转让给UNION。在这笔交易中,信达支付给UNION首付款2000万美元,未来还可能有2.47亿美元的里程碑付款,以及上市后的特许权使用费。
信达过往产品线布局及合作标的更多倾向于肿瘤治疗,其首次从外部引进皮肤病产品,且支付对价不低,足以引发对信达此举的猜测:是否嗅到了市场先机?
靶向药刷新用药选择
从统计数据看,皮肤病用药市场不论国内还是国外,近年都呈现出不断增长的势头。
根据咨询公司Prescient & Strategic给出的估计,2019 年全球皮肤病药品销售总额达252.282 亿美元,同时其预测在2020~2030 年间,市场的年复合年增长率仍有8.8%。细分市场报告也给出类似的增长率估计,市场调研机构Fortune Business Insights在其撰写的全球皮肤癌治疗报告中预测,皮肤癌市场的年复合年增长率为7.5%。
皮肤病市场规模扩增,受到患者需求及新药供给两端共同推动。需求端的主要增长因素包括患者对皮肤病的认识提高,人口老龄化加剧、皮肤病发病率上升、发展中国家可支配收入增加等。Prescient & Strategi特别提到,这几项因素在亚太地区的影响将尤为突出,因此未来10年亚太将成为全球皮肤病用药增长最快的地方,尤其中国和印度两个国家。
国内调研数据也显示,中国皮肤病用药市场规模不断扩大。根据米内网的统计,2018年全国皮肤病药品销售额达167.31亿人民币,2014~2018年均复合增长率7.66%。即使不考虑增速逐年加快的情况,按此数据推断,目前国内年皮肤药市场规模也已超过200亿人民币。
在本世纪之前,皮肤病经常被污名化,“牛皮癣”是电线杆上经常出现的字眼,也因此银屑病等皮肤病患者不少讳疾忌医,而疾病又严重影响病人的生活、工作信心。如今,更多患者寻求并得以接受规范化治疗,相关部门也在采取行动让患者就医更加便利。如2020年8月国家皮肤与免疫疾病临床医学研究中心启动了“银屑病规范化诊疗中心”建设项目,目前已有近200家医院完成注册。
同时,疾病谱的改变也在增加国内患者的用药需求。在2020年召开的中国康复医学会皮肤病康复专业委员会第三届学术年会上,专家提到国内皮肤病的疾病谱正在从此前的皮肤感染为主,向炎症、过敏、免疫紊乱、肿瘤等皮肤病转变,如特应性皮炎、银屑病等。
信达生物在交易新闻稿中估计,中国目前大约有5000万特应性皮炎患者和600万银屑病患者,且发病率随着生活方式的改变显示出逐步上升的趋势。这类皮肤病治疗通常需要长期用药,有利于市场扩容。
在药品供给这一端,大量皮肤病新药研发满足了临床用药需求。此前大多数皮肤病缺乏有效治疗手段,如特应性皮炎,一线疗法仍是外用糖皮质激素或者钙调磷酸酶抑制剂他克莫司等,但效果经常不太理想,又有令人担心的副作用。而靶向药如PDE4、IL-13、JAK抑制剂的出现,为中重度特应性皮炎患者提供了新的治疗选择,也拉动了皮肤病市场的用药需求。
初步统计从2015年至今,FDA、EMA批准的皮肤病相关产品达29个。感染性皮肤病、炎症性皮肤病及皮肤肿瘤这三种主要皮肤病类型都有新药获批上市(详见下表)
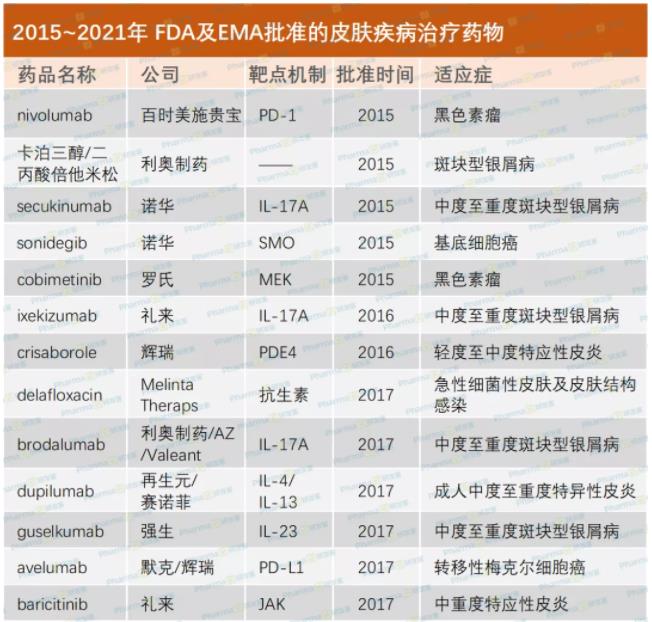
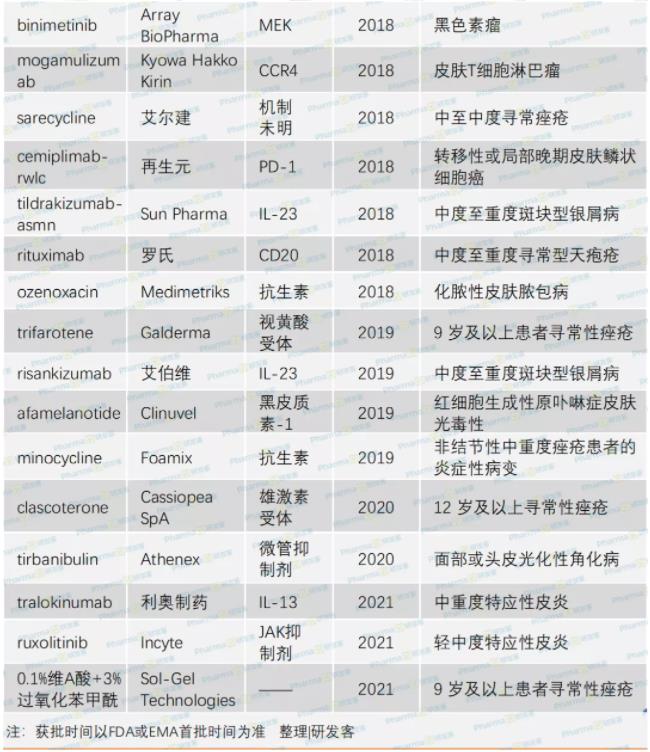
其中,炎症性皮肤病及皮肤肿瘤,如银屑病、特应性皮炎、黑素瘤等新药获批,为皮肤病治疗及市场前景带来了颠覆性改变。有专家提及在生物制剂上市之前,多数银屑病患者都对治疗结果不满意,而现在不少患者可达到90%~100%的皮损消退,且能维持疾病长期不复发。
新药提升了患者治疗及医生处方的热情,创新单品不断刷新皮肤病用药销售历史记录。
2015年上市的诺华的secukinumab(Cosentyx),2020年全球销售额达39.95亿美元;
而2017年上市的赛诺菲的dupilumab(Dupixent)2020年销售额已突破40亿美元,预计该产品峰值销售额可达百亿美元;
2019年刚获批的艾伯维的risankizumab(Skyrizi)同样不甘示弱,上市第二年就交出15.9亿美元的成绩单。
而全球历史悠久的专业皮肤病新药研发公司利奥制药,上表提及其近年有3个新药获批上市,2020年也实现全球销售额13.59亿欧元(约15.76亿美元)。
肿瘤靶点的跨界
炎症性皮肤病新药开发靶向化趋势明显,细胞因子IL-13、IL-17,以及JAK、PDE4等都成为研发的热门靶点。
而近年免疫靶点药物在肿瘤治疗上取得的成功,也令皮肤病新药研发产生了一个有趣的现象:有不少肿瘤药跨界炎症性皮肤病适应症开发,皮肤病也为红海中惨烈厮杀的肿瘤药留下一片施展身手的广阔天地。
如上表中罗氏旗下的CD20单克隆抗体rituximab(利妥昔单抗),该药首先被FDA批准用于非霍奇金淋巴瘤和慢性淋巴性白血病治疗。2018年适应症拓展至中度至重度寻常型天疱疮,其也成为FDA批准的首个用于天疱疮治疗的生物制剂。
同样的还有Incyte的JAK抑制剂ruxolitinib(芦可替尼)乳膏,该产品此前已获批3项适应症,分别用于治疗骨髓纤维化、真性红细胞增多症和移植物抗宿主病。FDA今年批准其新剂型用于12岁以上轻中度特应性皮炎(AD)患者的治疗,是FDA批准的首个JAK抑制剂外用制剂。该产品目前还递交了白癜风适应症的上市申请,正在等待审批。
其他多款JAK抑制剂也有皮肤适应症相关研究正在进行,如获得FDA突破性疗法认定用于斑秃治疗的ritlecitinib,该产品由辉瑞研发。
针对皮肤病新药研发最近出现的这一特点,部分公司嗅到了先机,与外界广泛开展合作研究。利奥制药专门成立开放式创新平台,为外部公司、科研机构和大学提供免费的皮肤病相关分子表型测试。这一开放式创新平台启动6年来,已为来自全球27个国家165个合作伙伴的3000个不同分子提供过测试。
皮肤病新药研发的另一趋势还在于药物递送方式的改变。以往皮肤用药多采用局部涂抹,如今更多新药开发系统性给药方案。一方面受到新产品分子类型的影响,如IL-13、IL-17抑制剂等,均为单抗类药品,更适合于静脉给药。另一方面,对于皮损较大的中重度患者,全身给药提高了用药的便利性。
但系统性给药对于皮肤病产品开发,既是机会亦是挑战。系统性给药可以为产品开发带来差异化,如:同为PDE4抑制剂,辉瑞的crisaborole是外用制剂,其适应症为轻度至中度特应性皮炎,而信达此次引进的orismilas是一款口服制剂,目标适应症为中重度特应性皮炎。
然而,系统性给药也面临安全性方面的挑战,多数炎症性皮肤病患者需要长期用药,监管部门对这类产品的安全性要求亦十分严格,产品首先要有良好的安全性才能开发为系统系给药剂型。
罕见皮肤病有药可治
罕见病也成为皮肤病药物研发的一大热点,FDA已给予多个罕见皮肤病治疗药物上市批准。
辉瑞和默克共同研发的PD-1/L1抑制剂avelumab,该产品首个获批的适应症是梅克尔细胞癌。原先罹患该疾病的患者只能接受化疗,新药为患者提供了更多的治疗选择,2017年和2019年FDA接连批准avelumab以及默沙东的帕博利珠单抗用于这一疾病治疗。
皮肤T细胞淋巴瘤也是比较罕见的皮肤病,复发或难治性蕈样真菌病(mycosis fugoides, MF)或塞扎里综合征(Sezary syndrome, SS)是该疾病的其中两种类型,2018年FDA批准日本协和发酵麒麟研发的mogamulizumab-kpkc上市,用于MF和SS治疗,这也是SS首个获批的疗法。
也有产品研发针对罕见疾病引起的皮肤病变。如Clinuvel公司开发的afamelanotide,可用于治疗红细胞生成性原卟啉病引起的皮肤光损伤。
FDA对于罕见皮肤病新药研发态度积极,不少产品给予突破性疗法或孤儿药认定,审评时亦会适当加速。罕见皮肤适应症也帮助部分热门靶点新药研发的后起之秀,争得了市场的一席之地。除avelumab外,另一款PD-1抑制剂——赛诺菲/再生元的cemiplimab,也已获得局部晚期皮肤鳞状细胞癌和基底细胞癌两个皮肤相关适应症的上市批准。
国内“研家”日益活跃
中国的皮肤病新药研发也逐渐活跃起来。
其中特别有意思的是,虽然国内皮肤病新药研发目前热度还不算高,但已有多项产品实现国外授权。
如已在2019年获国家药监局批准上市的本维莫德(benvitimod/tapinarof)乳膏,该产品可用于局部治疗成人轻至中度稳定性寻常型银屑病。这一新药的专利拥有者是北京文丰天济的陈庚辉团队,产品2009年开始研发,2012年完成Ⅱ期临床时即被GSK看上,其花费2.3亿美元得到了本维莫德除中国以外市场的开发权,后又在2018年以3.3亿美元的价格转让给Dermavant。今年8月Dermavant宣布FDA已接受该产品用于成人斑块状银屑病的NDA申请,有望明年二季度获批。
此外,恒瑞医药JAK1抑制剂SHR0302,也于2018年将该产品的皮肤适应症在美国、欧盟和日本的开发权利授权给Arcutis,预计恒瑞从中可获得共2.23亿美元的首付款和里程碑款,外加销售提成。目前恒瑞也在国内开展该产品用于特应性皮炎、斑秃等的临床研究。
也有国内公司从国外引进皮肤病产品。如科笛生物引进了FDA 2019年批准上市的米诺环素局部用泡沫剂,用于痤疮治疗。同时其也引进用于玫瑰痤疮及男性雄激素性脱发的几款产品。脱发这一适应症国内还有多家生物技术公司有产品布局,开拓药业研发的福瑞他恩(KX-826)正在开展II期临床研究,特科罗生物的TDM-105795也进入I期临床阶段。
预计未来中国皮肤病市场会有更多参与者加入,也许不用多久,国内皮肤病新药研发也会呈现一派欣欣向荣的景象。

 产业资讯
产业资讯
 医曜
医曜  2025-08-14
2025-08-14
 13
13

 产业资讯
产业资讯
 研发客
研发客  2025-08-14
2025-08-14
 12
12

 产业资讯
产业资讯
 药明康德
药明康德  2025-08-14
2025-08-14
 12
12