 产业资讯
产业资讯
 米内网
米内网  2022-01-04
2022-01-04
 3252
3252
摘要
12月CDE共承办药品注册申请1366件
11个存量品种首次有企业申报一致性评价
5个1类新药报产,6个重磅品种有新适应上市申请
仿制申请中有24个品种暂无国产获批
6个1类创新药获批,其中3款为1.1类中药创新药
2个首仿品种获批,8个存量品种迎首家过评
CDE总体承办情况
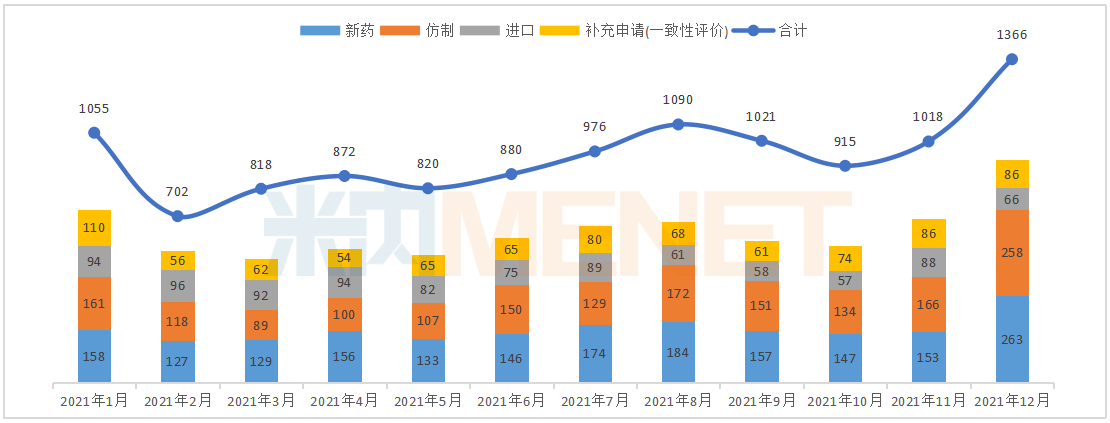
据米内网MED2.0中国药品审评数据库统计,2021年12月CDE共承办药品注册申请1366件。
2021年1月-12月CDE承办药品注册申请情况(按受理号计)
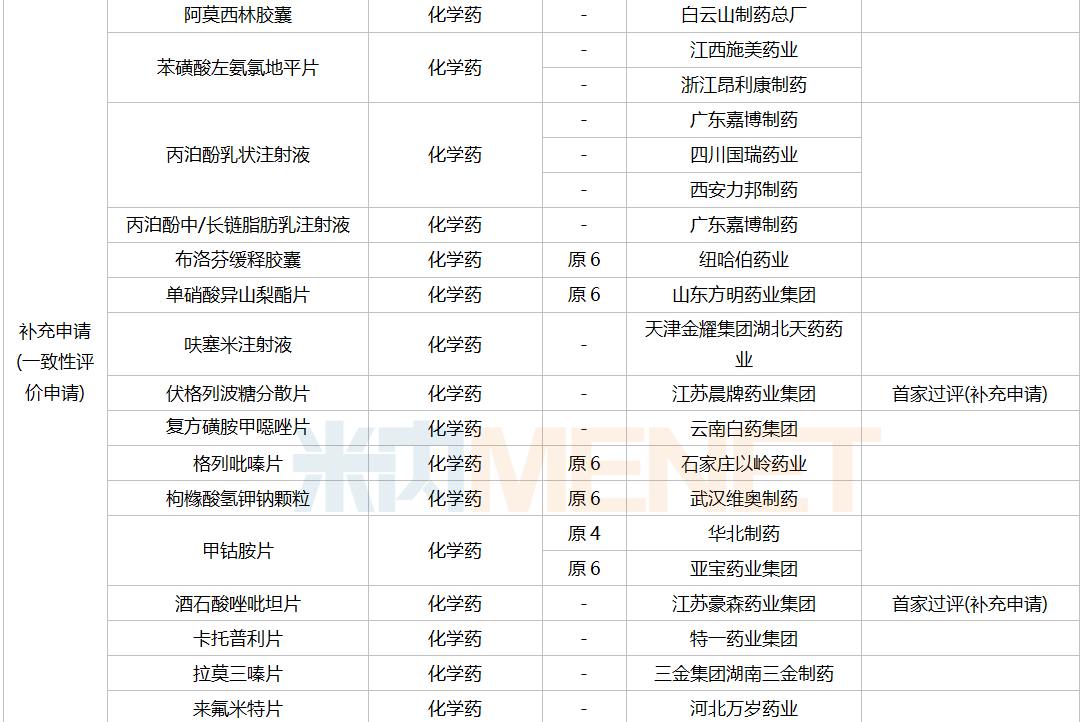
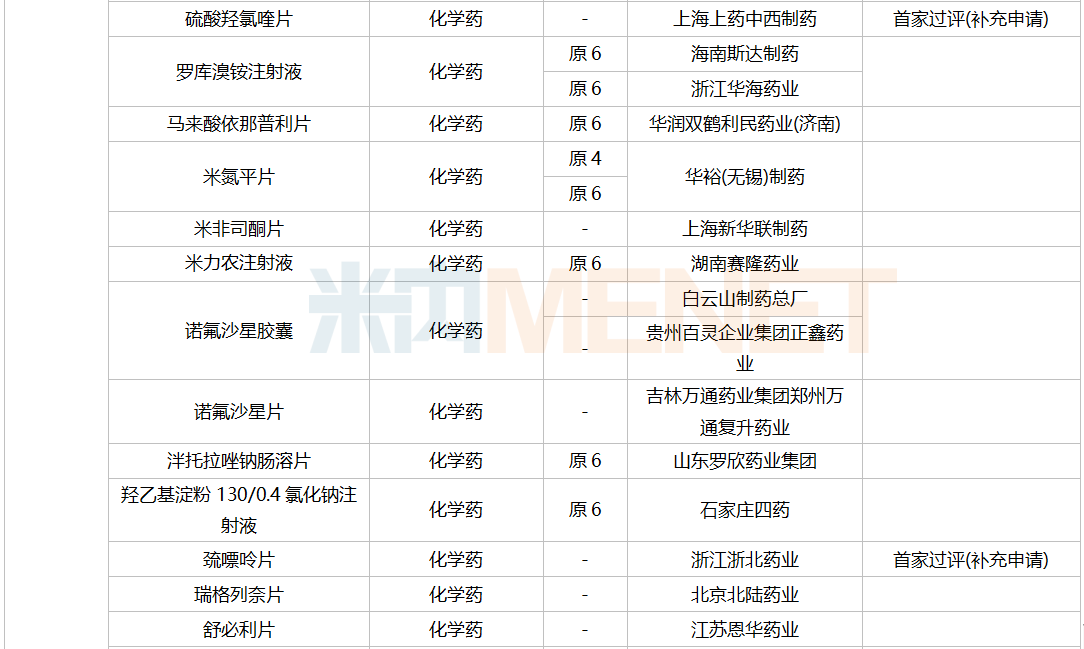
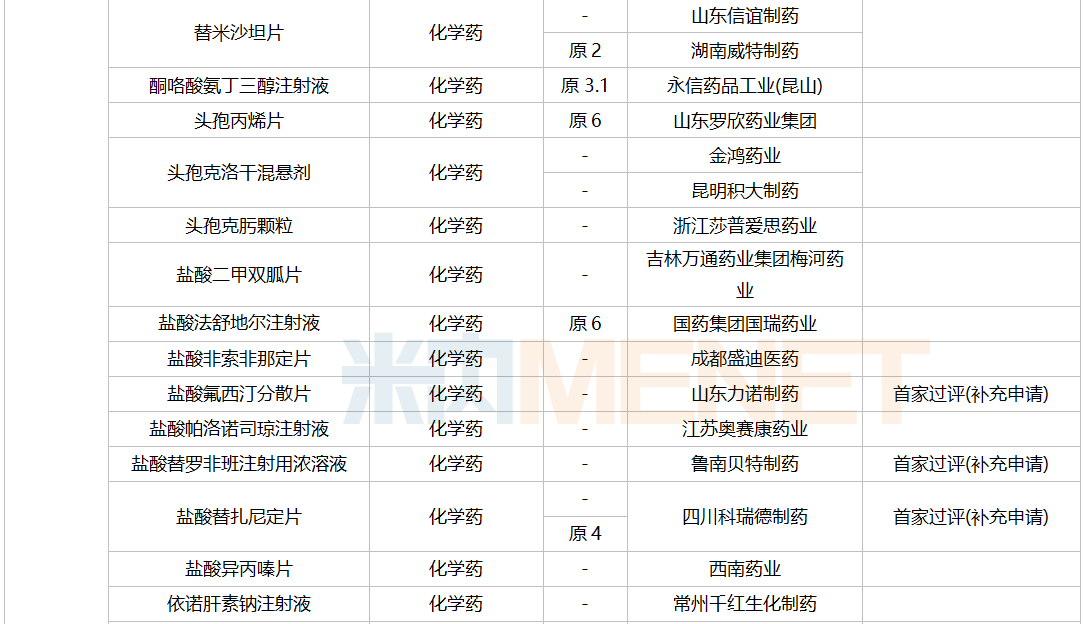
一致性评价补充申请承办情况
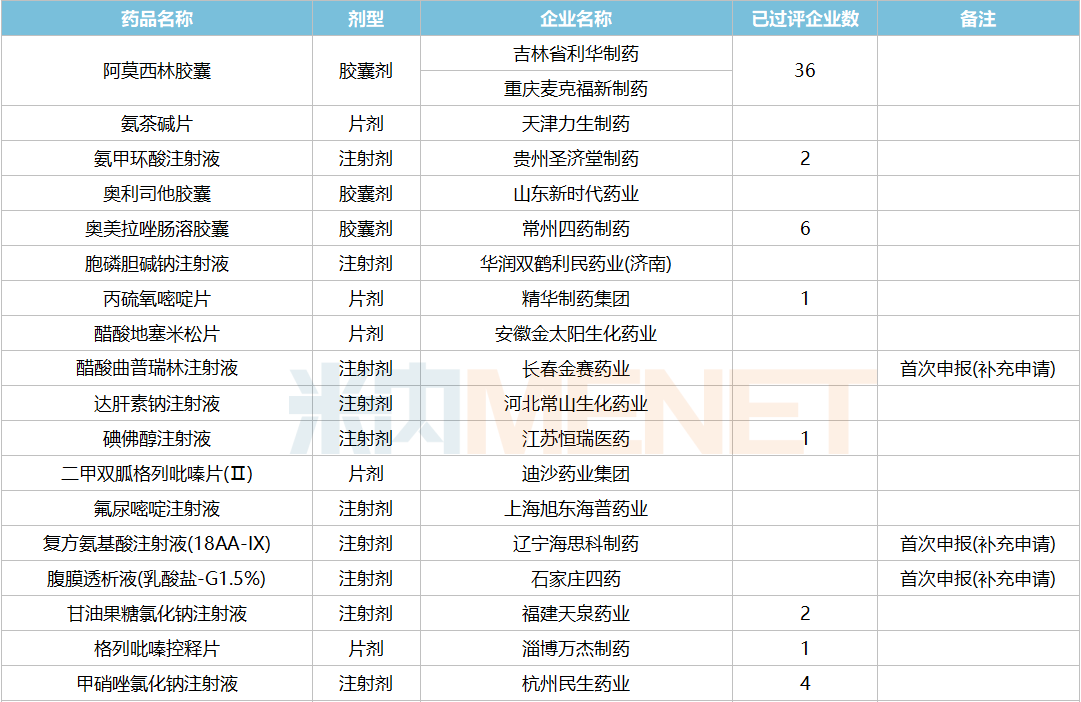
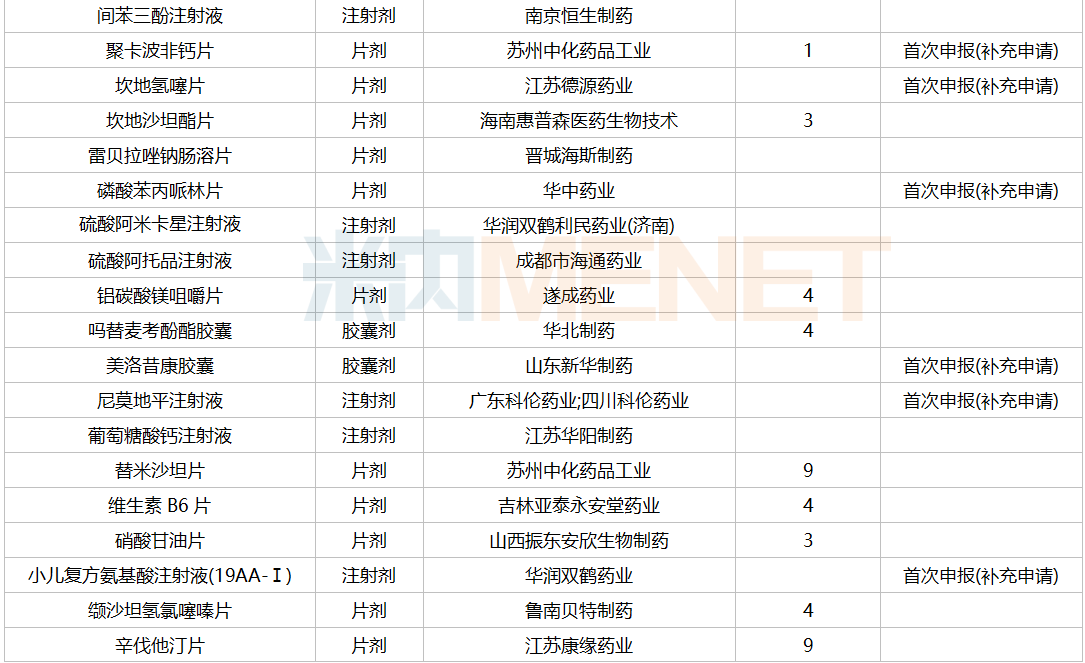
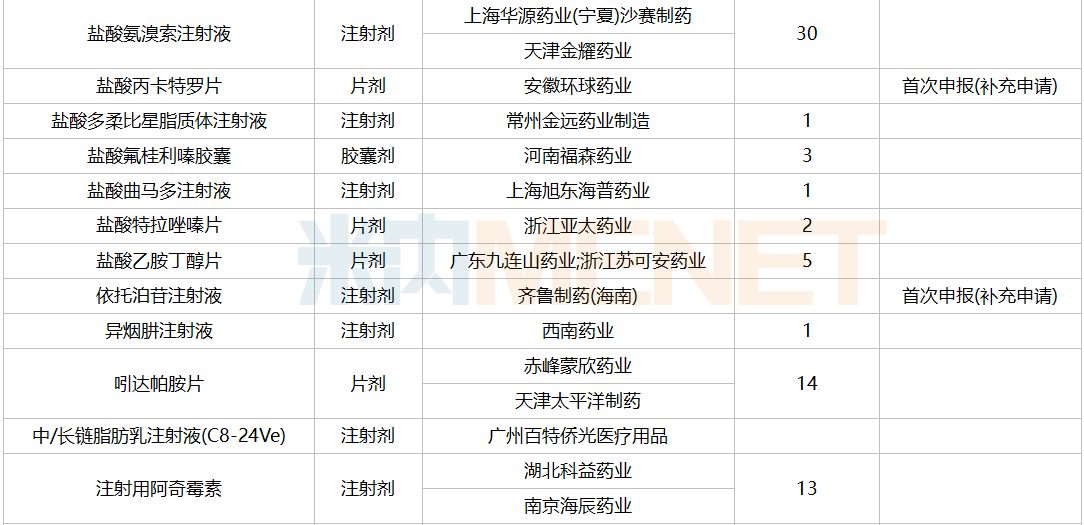
2021年12月,61个品种的一致性评价补充申请获CDE承办。11个品种为首次提交一致性评价补充申请:醋酸曲普瑞林注射液、复方氨基酸注射液(18AA-IX)、腹膜透析液(乳酸盐-G1.5%)、聚卡波非钙片、坎地氢噻片、磷酸苯丙哌林片、美洛昔康胶囊、尼莫地平注射液、小儿复方氨基酸注射液(19AA-Ⅰ)、盐酸丙卡特罗片、依托泊苷注射液。详细情况见下表:
12月CDE补充申请(一致性评价)品种承办情况

新药申请承办情况
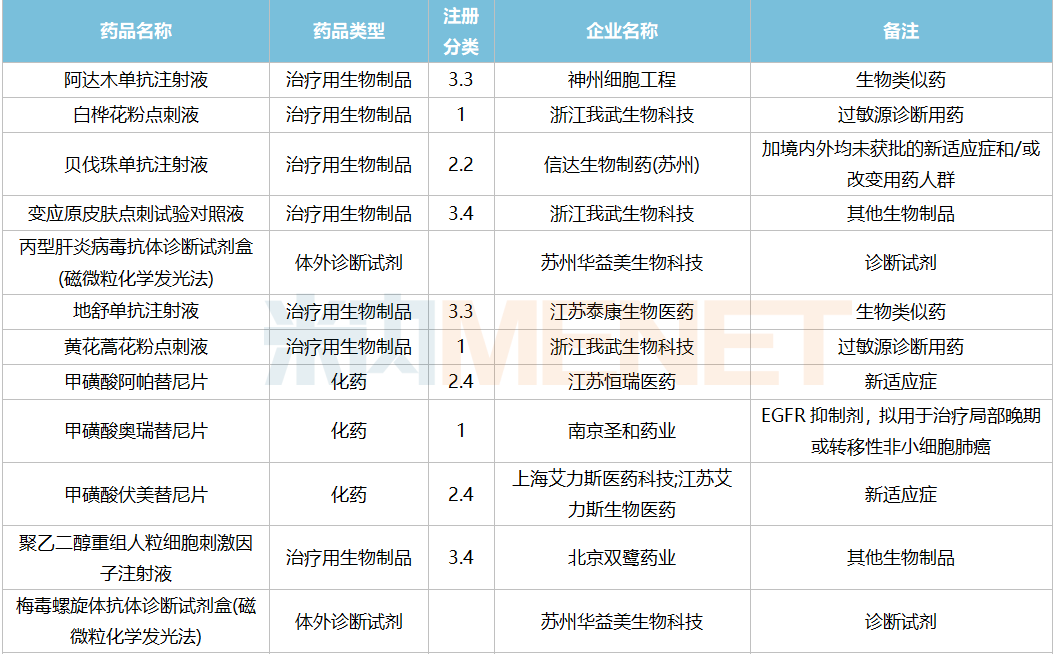
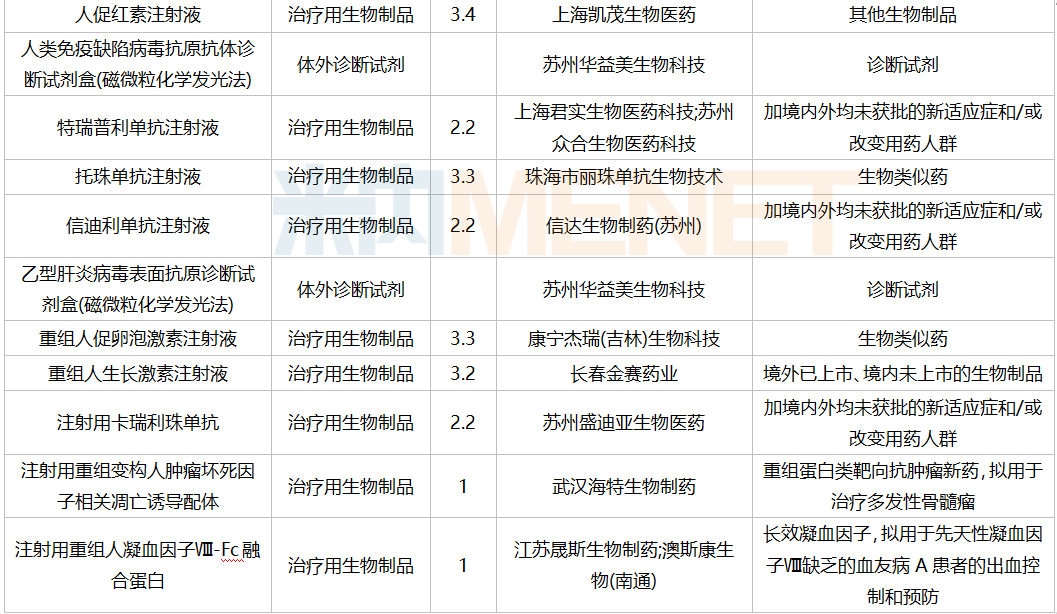
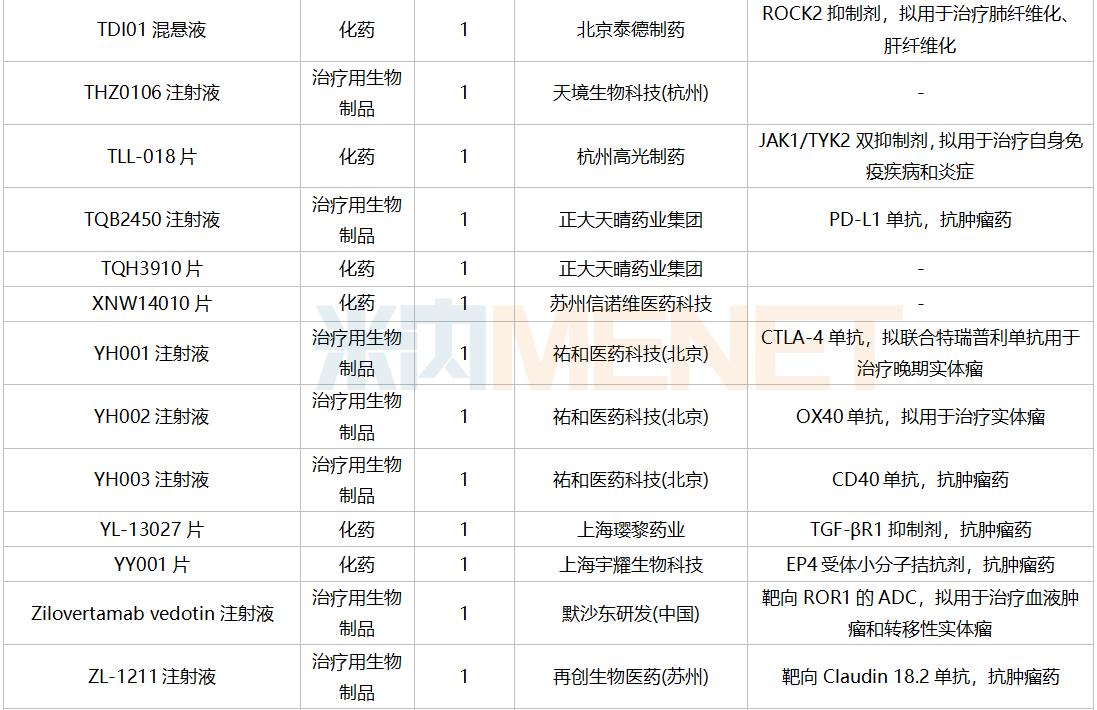
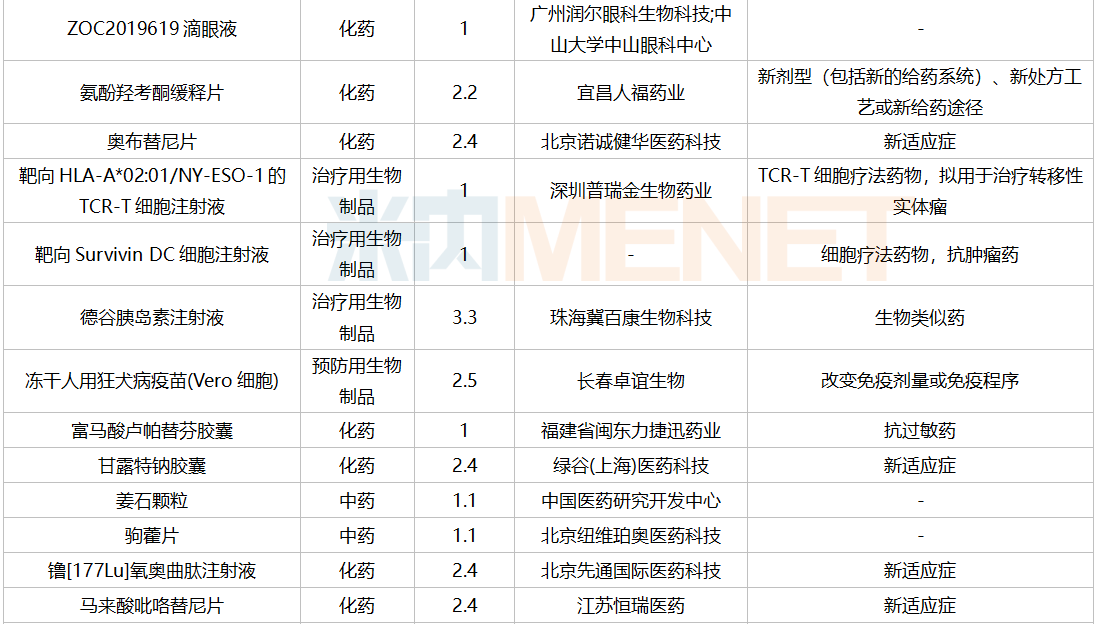
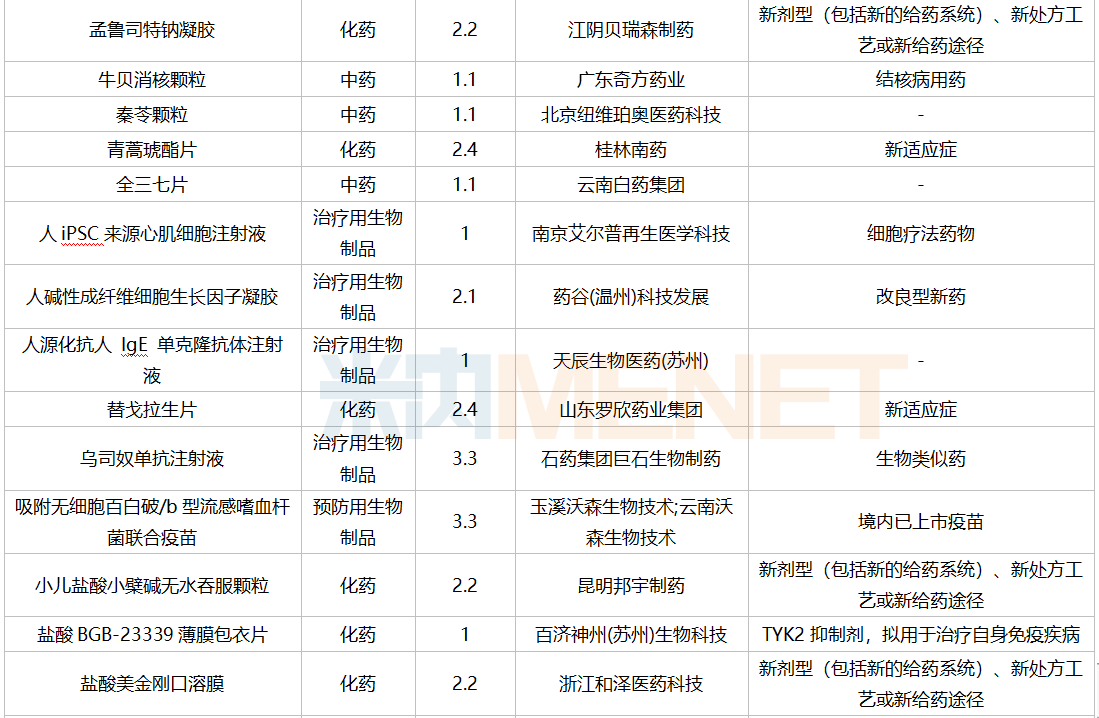
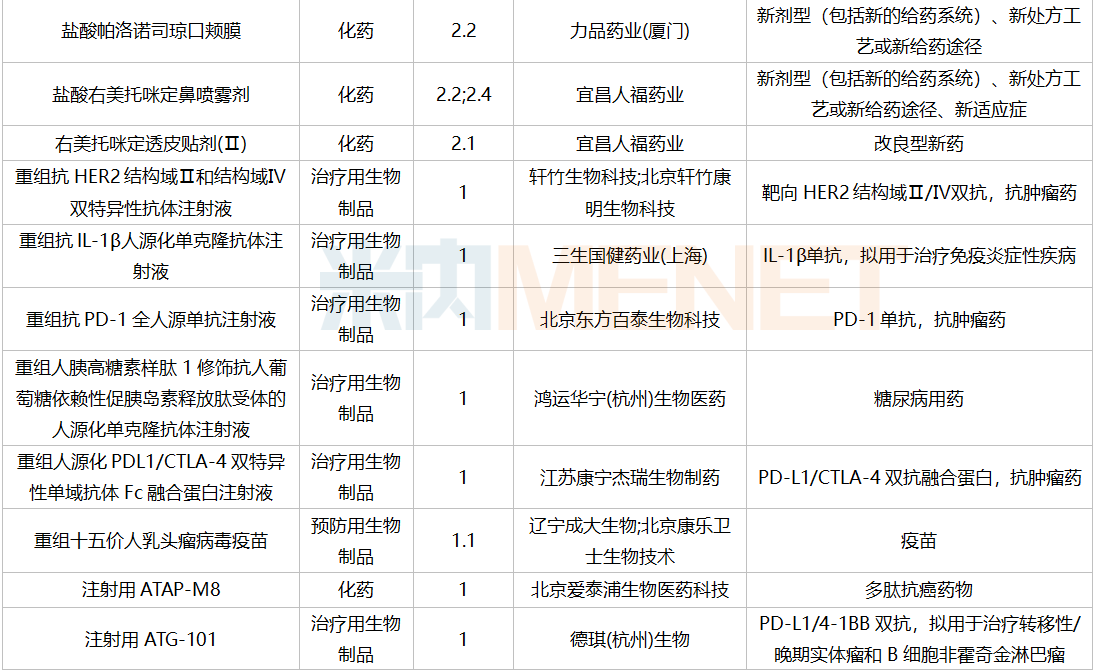
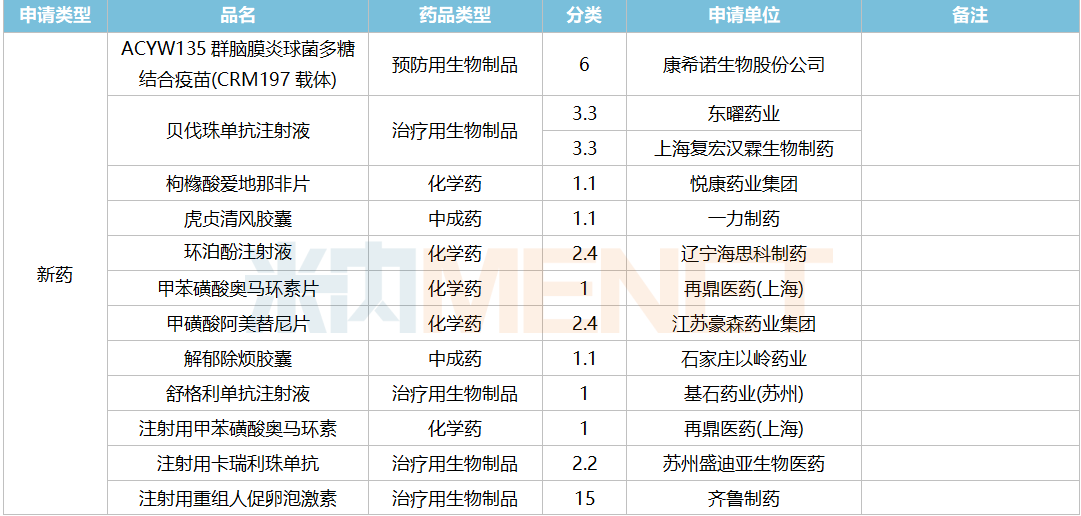
2021年12月,169个品种的新药申请获CDE承办。其中1类新药有122个,2类改良型新药有32个,3.3类生物类似药7个。
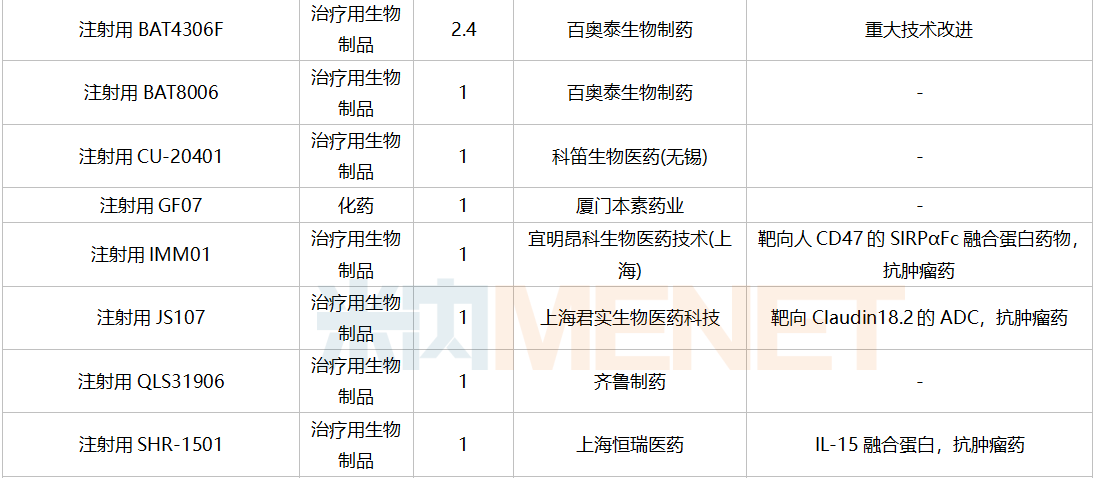
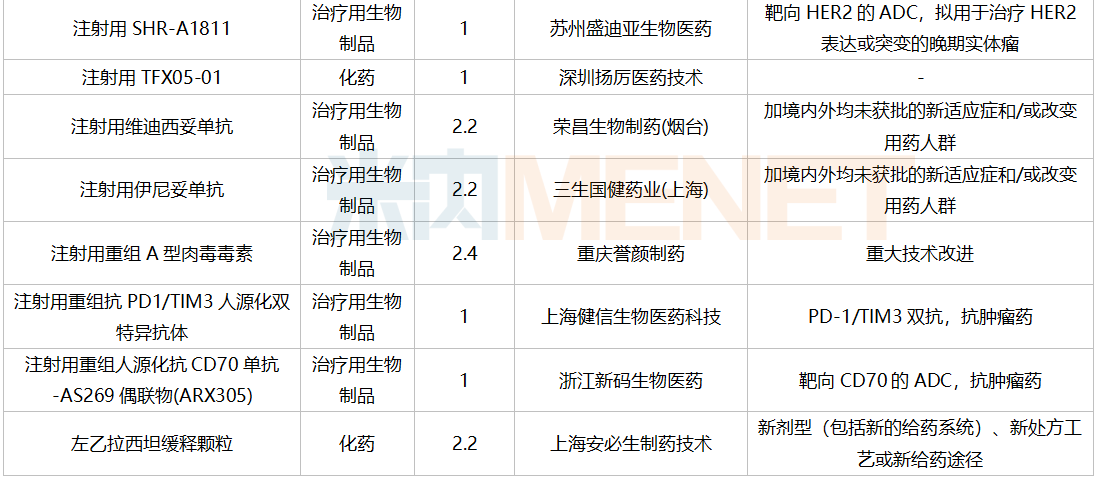
南京圣和药业提交1类新药甲磺酸奥瑞替尼片上市申请。此外,江苏恒瑞医药的甲磺酸阿帕替尼片和注射用卡瑞利珠单抗、上海艾力斯医药的甲磺酸伏美替尼片、信达生物的贝伐珠单抗注射液和信迪利单抗注射液、上海君实生物的特瑞普利单抗注射液等均有新适应症上市申请。
12月国内新药上市申请承办情况
12月国内新药临床申请承办情况
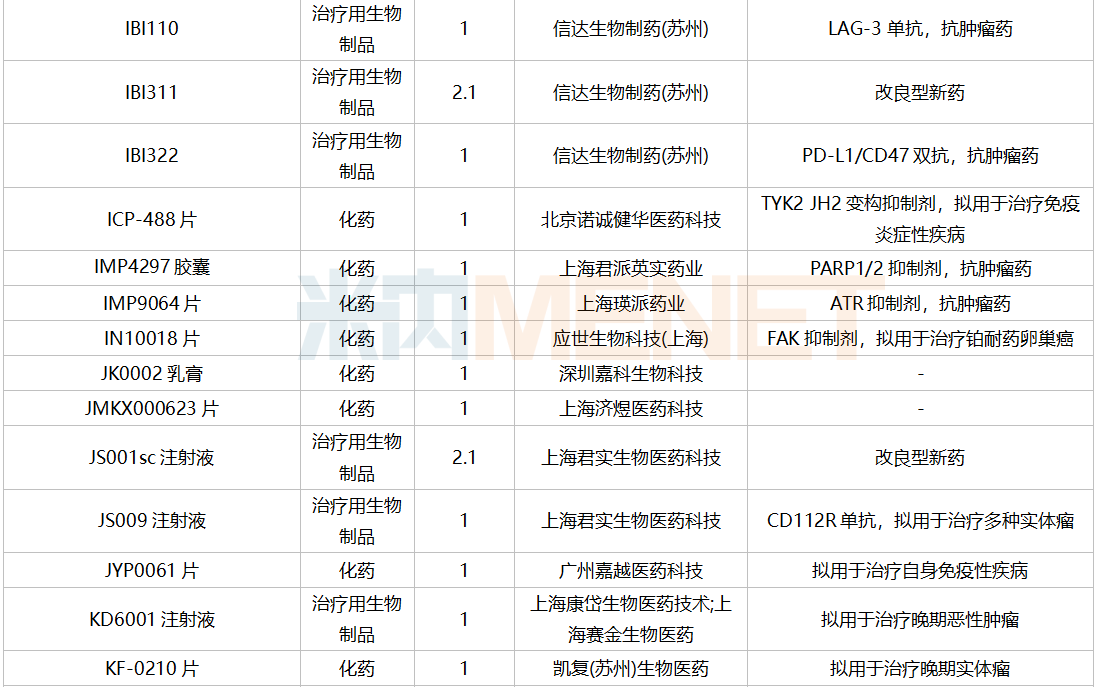
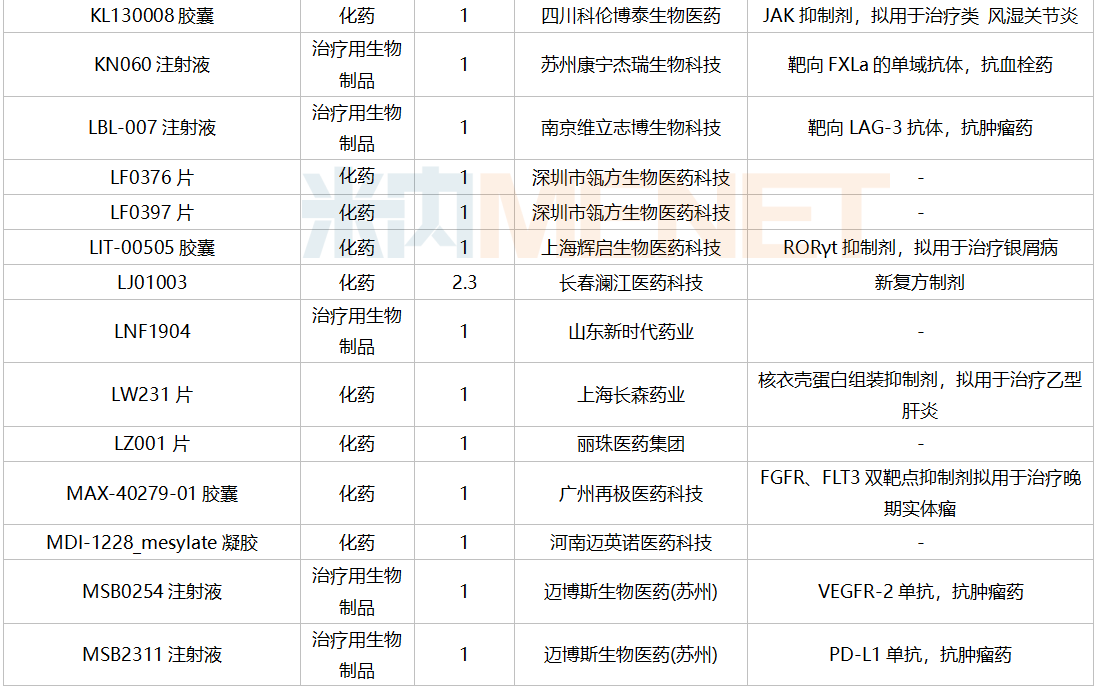
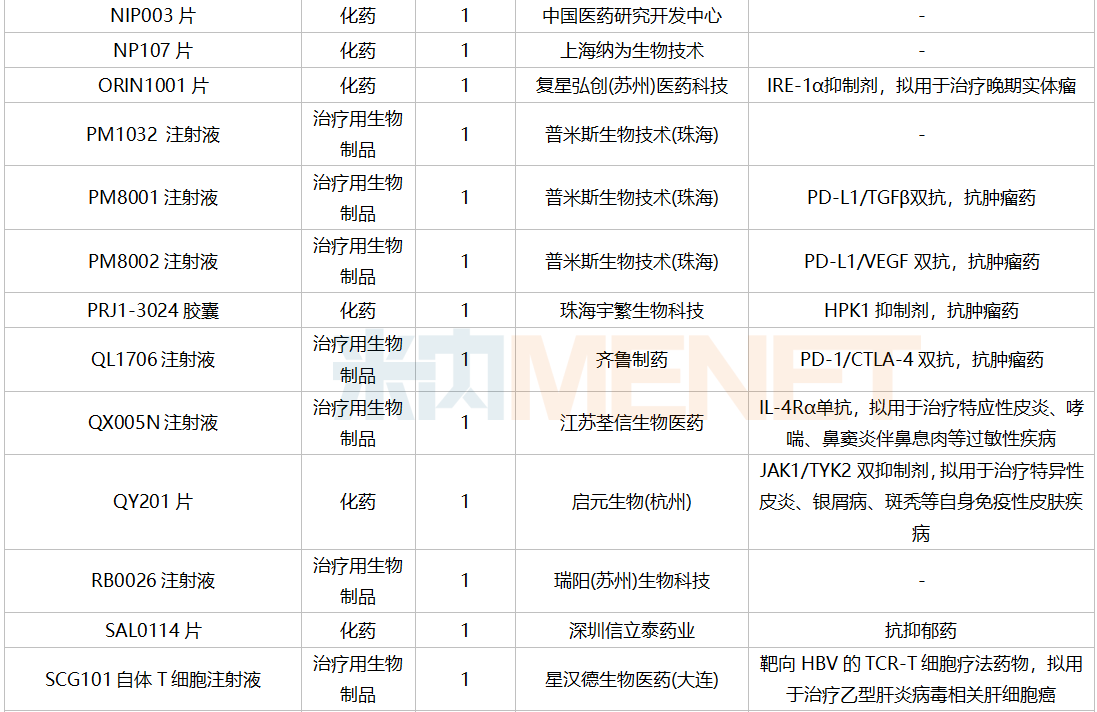
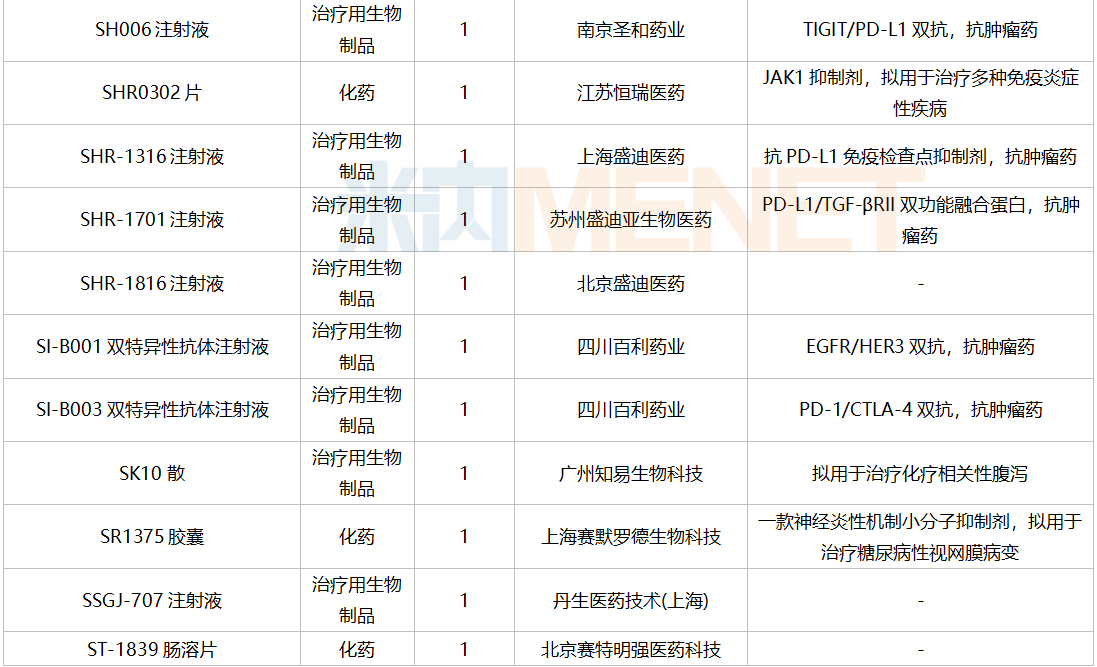
仿制申请承办情况
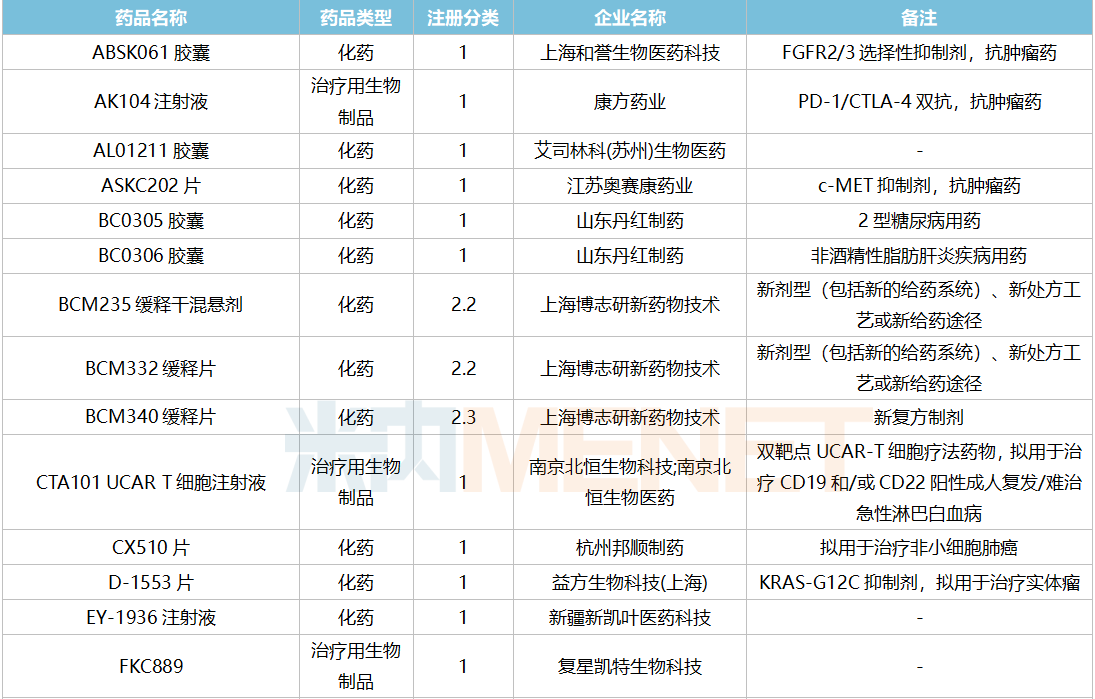
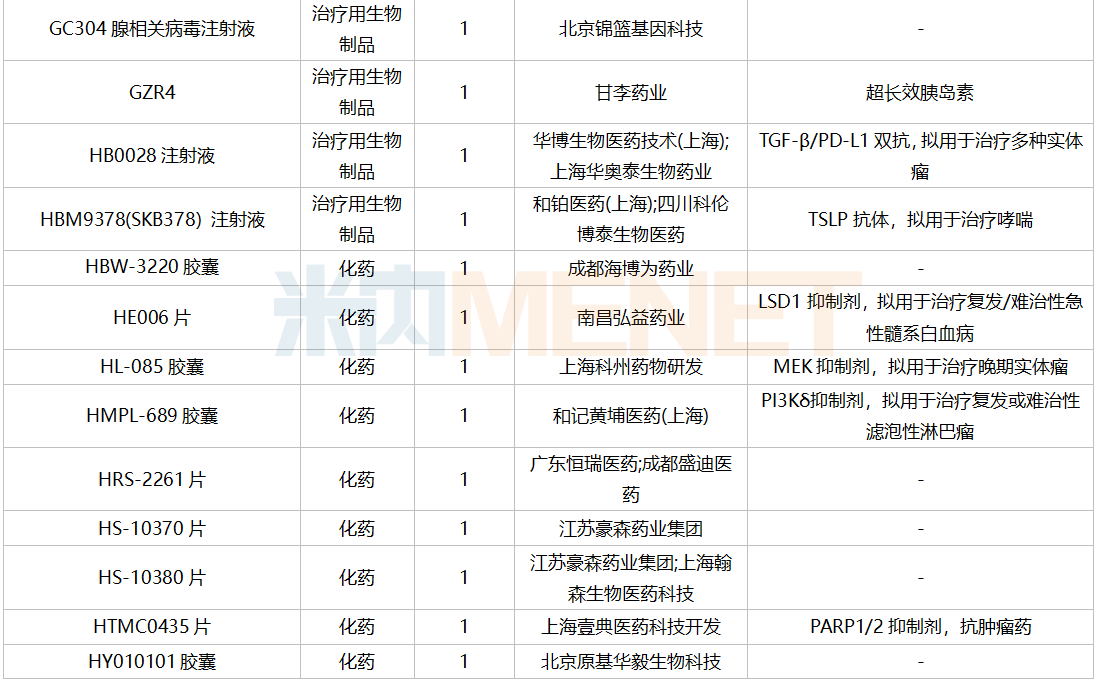
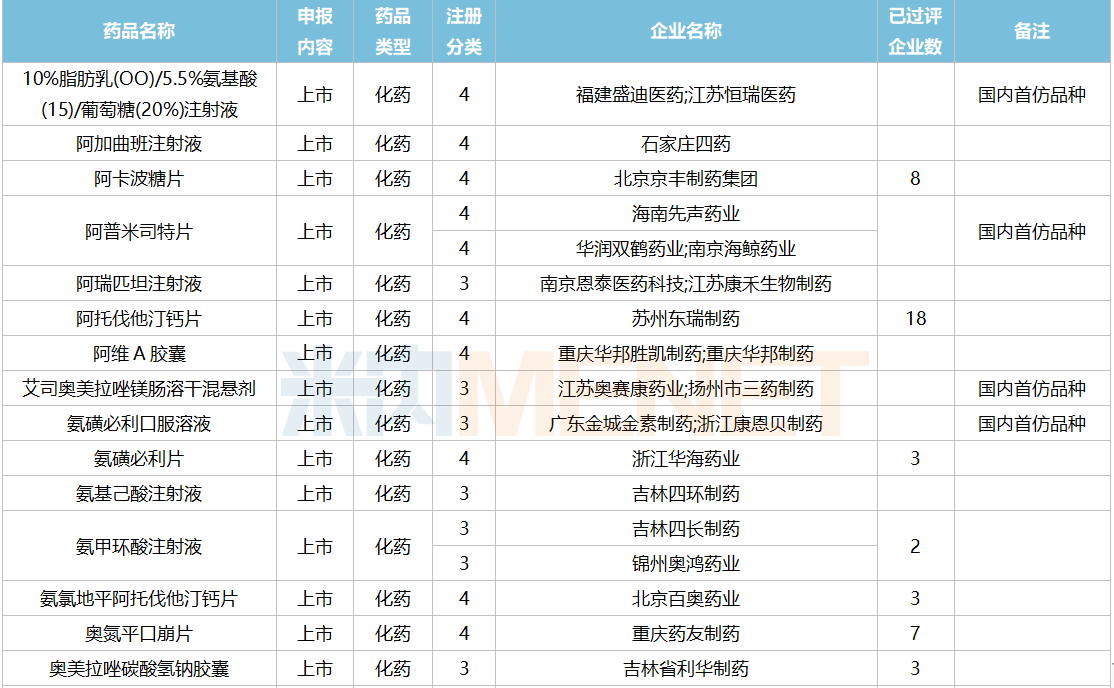
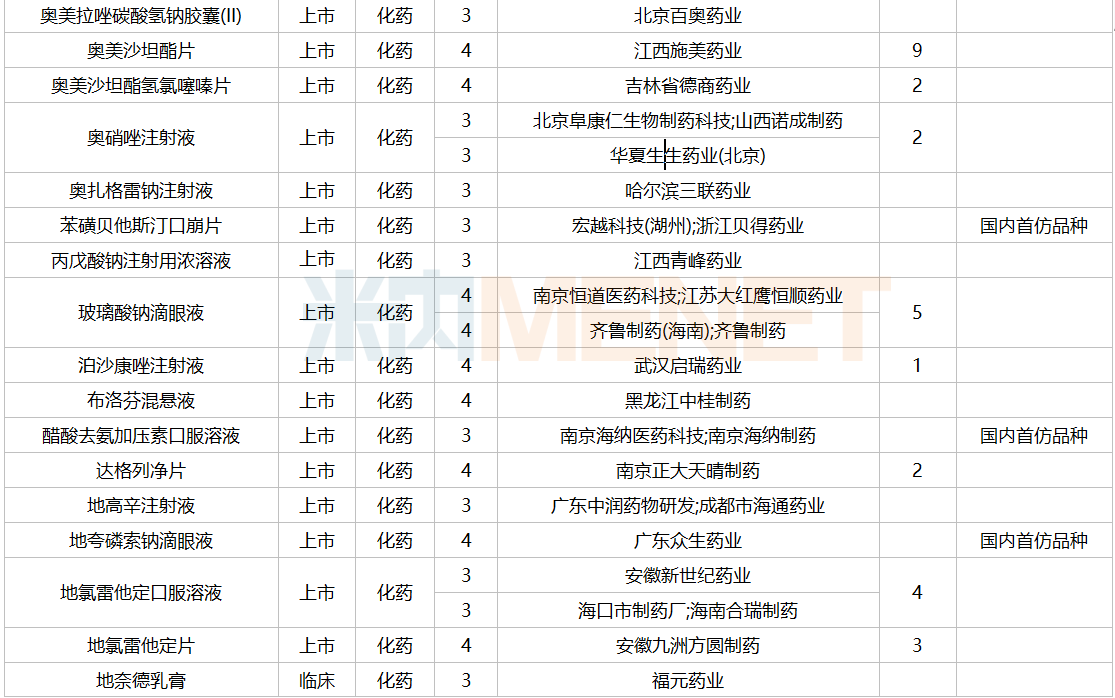
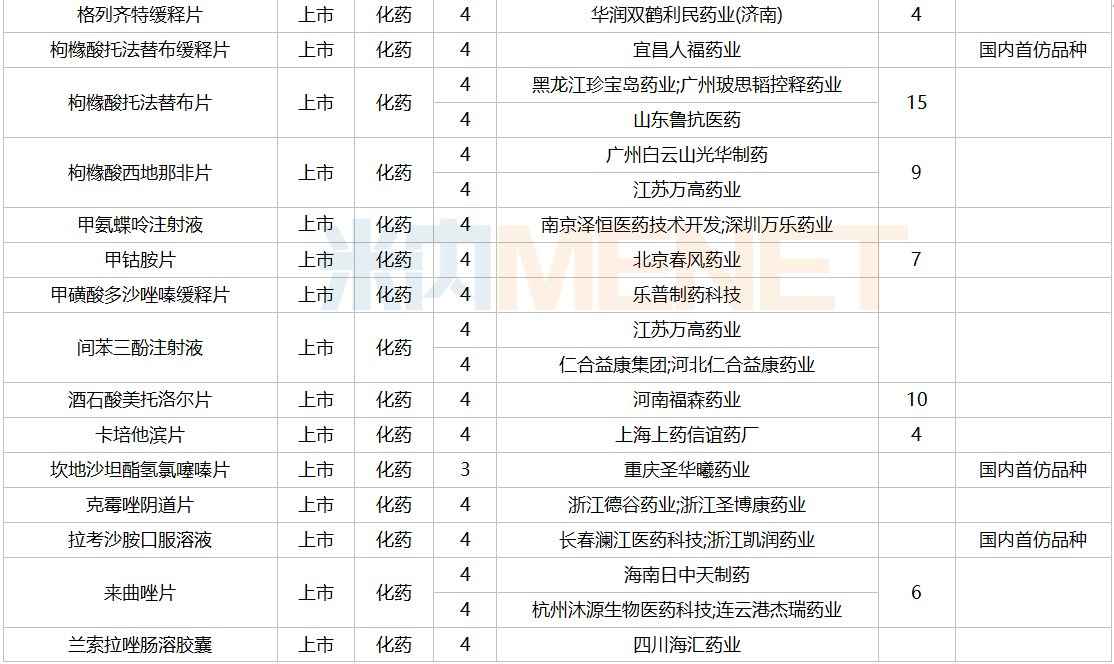
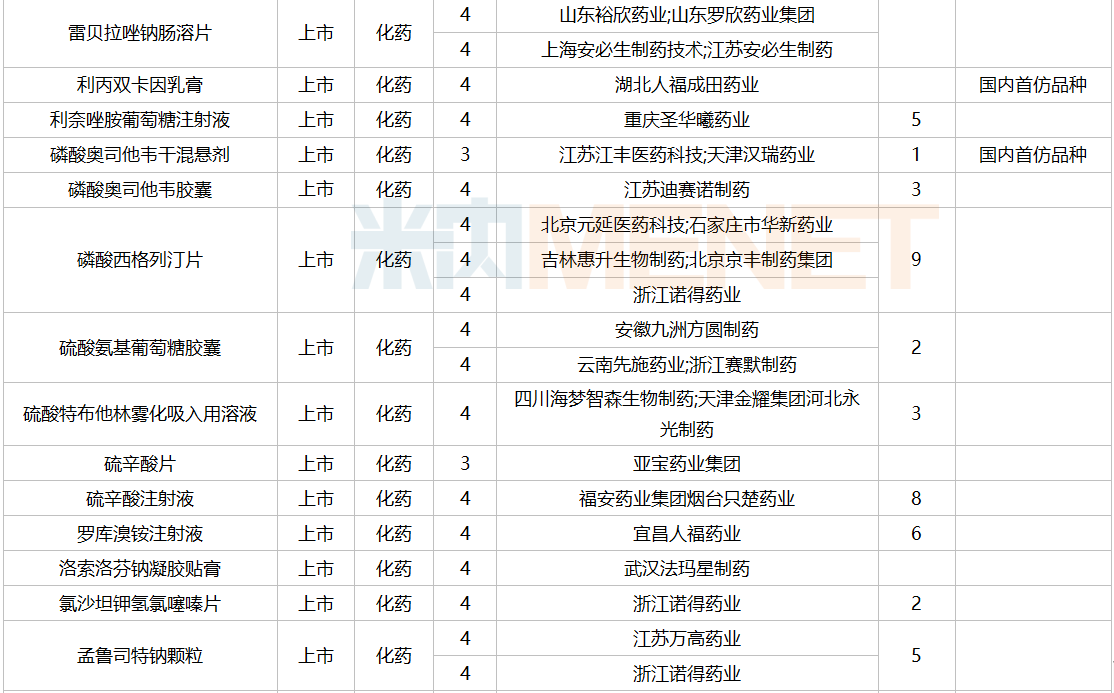
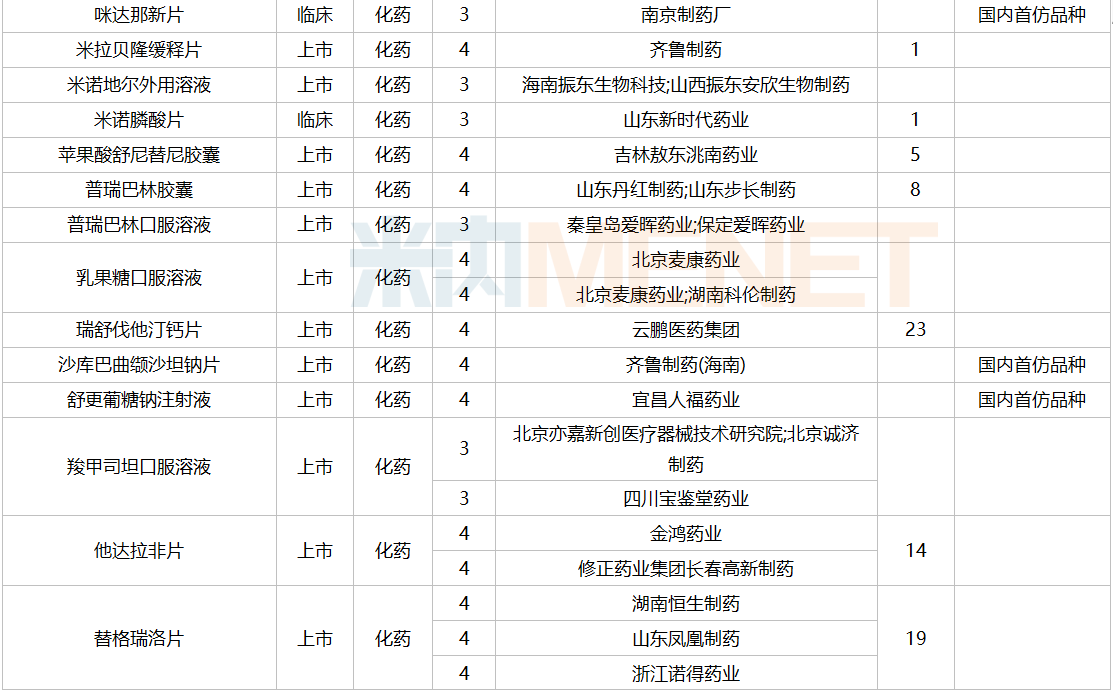
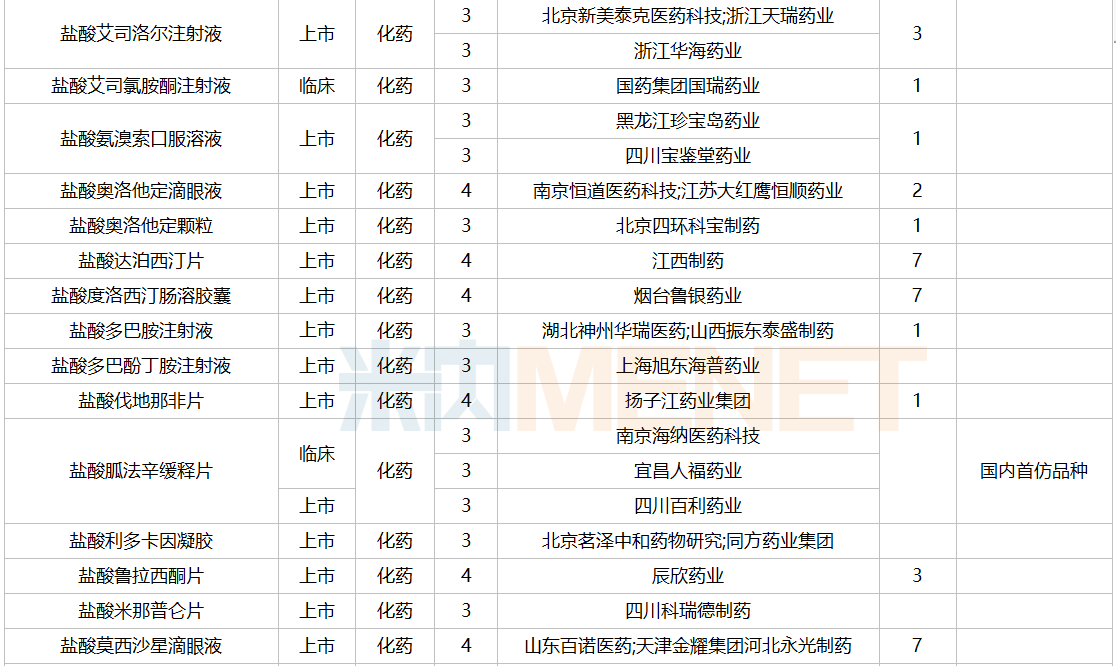
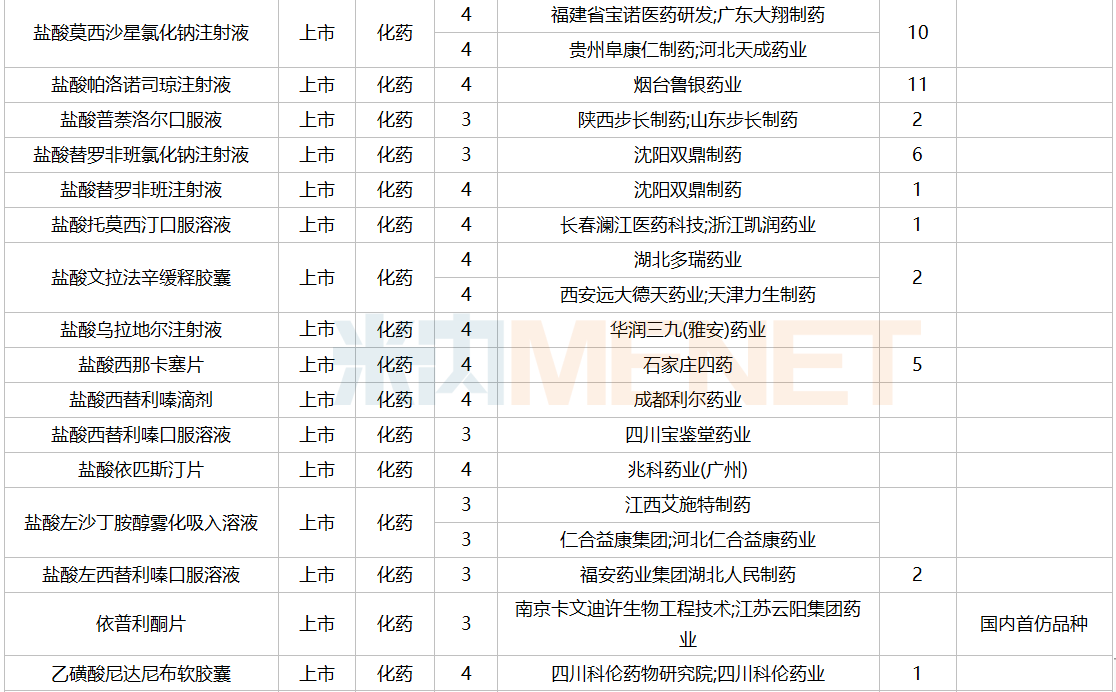
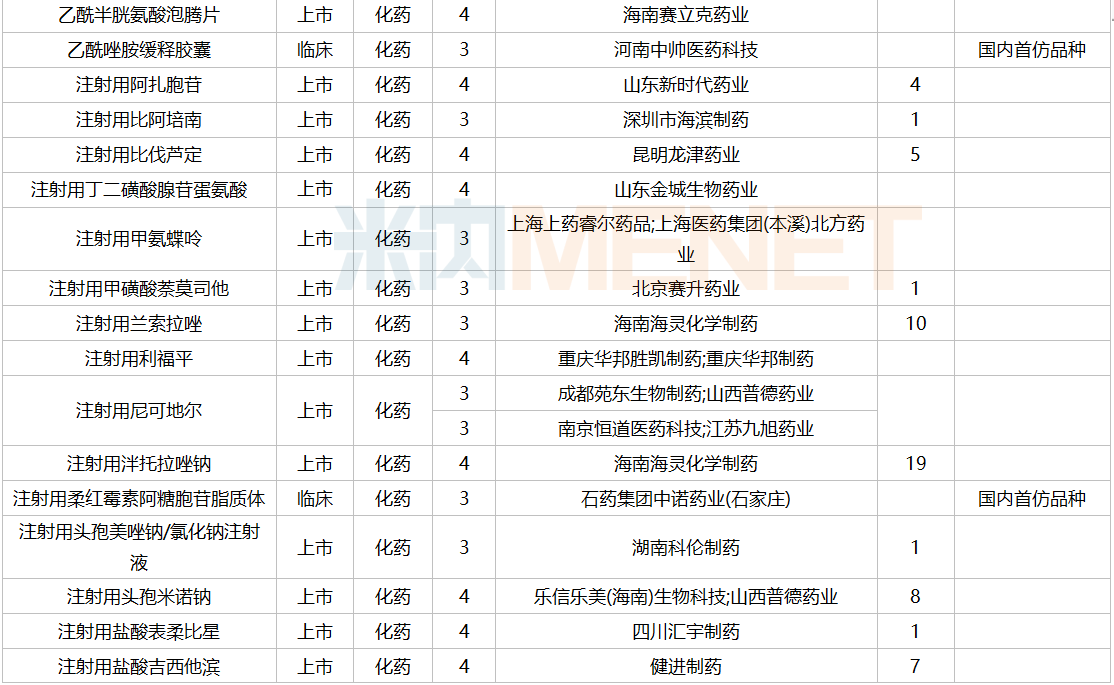
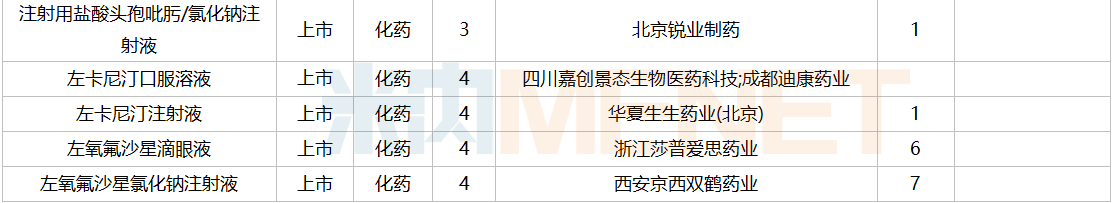
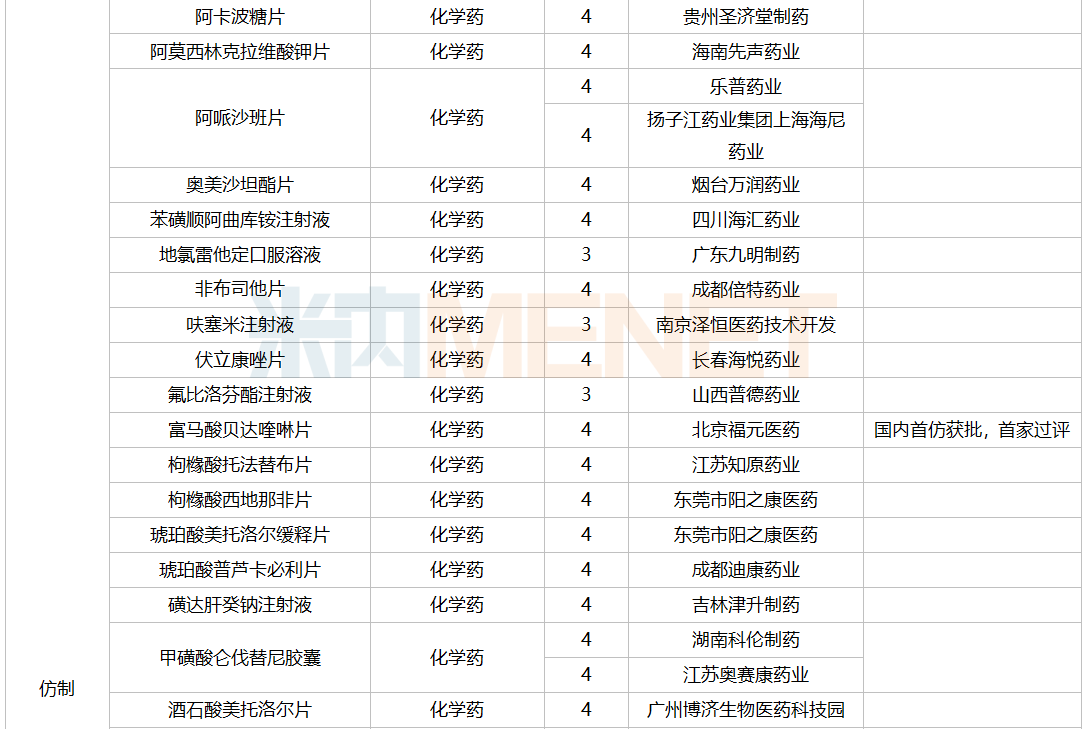
2021年12月,159个品种的仿制申请获CDE承办,其中24个品种暂无国产获批:10%脂肪乳(OO)/5.5%氨基酸(15)/葡萄糖(20%)注射液、阿普米司特片、艾司奥美拉唑镁肠溶干混悬剂、氨磺必利口服溶液、苯磺贝他斯汀口崩片、醋酸去氨加压素口服溶液、地夸磷索钠滴眼液、地屈孕酮片、噁拉戈利片、富马酸福莫特罗吸入溶液、枸橼酸托法替布缓释片、坎地沙坦酯氢氯噻嗪片、拉考沙胺口服溶液、利丙双卡因乳膏、磷酸奥司他韦干混悬剂、咪达那新片、沙库巴曲缬沙坦钠片、舒更葡糖钠注射液、溴夫定片、盐酸阿罗洛尔片、盐酸胍法辛缓释片、依普利酮片、乙酰唑胺缓释胶囊、注射用柔红霉素阿糖胞苷脂质体。详细情况见下表:
12月国内仿制申请承办情况


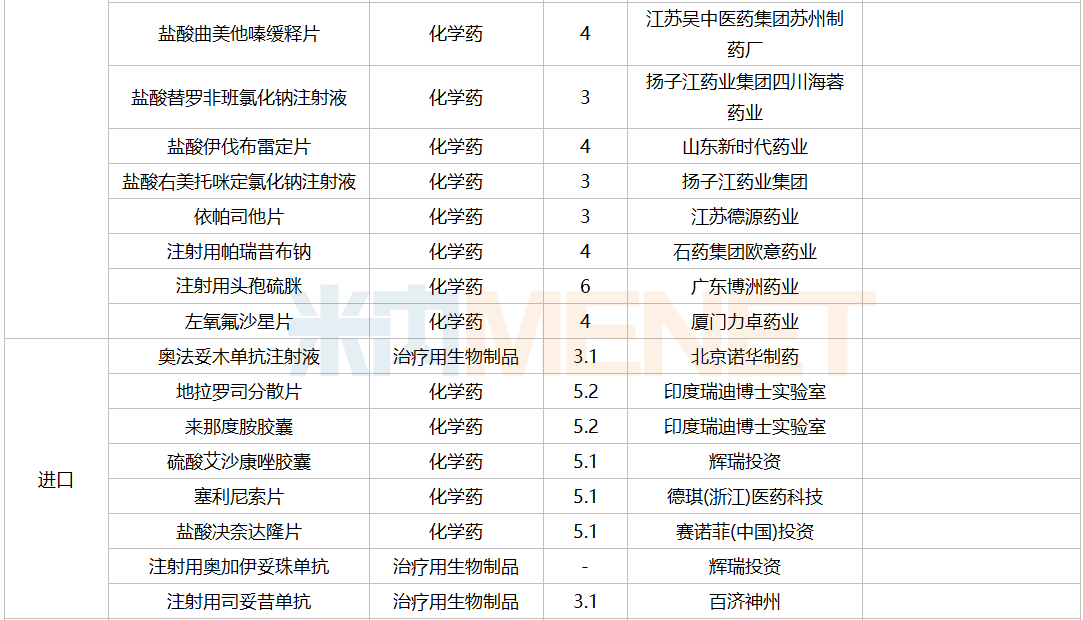
进口申请承办情况
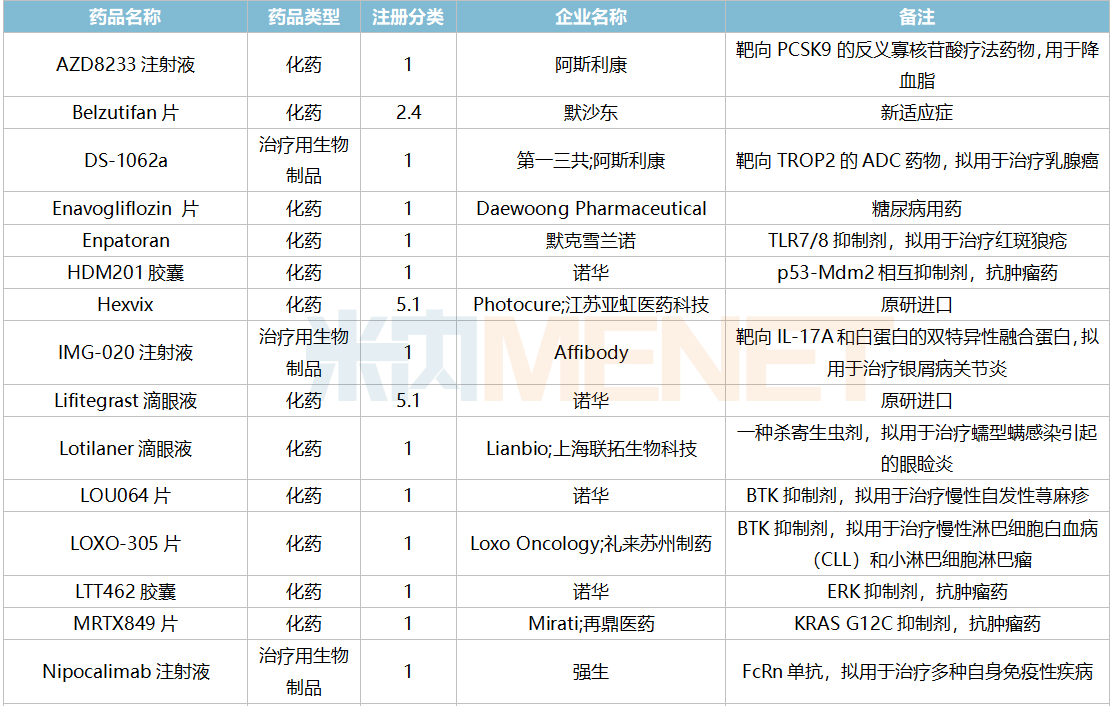
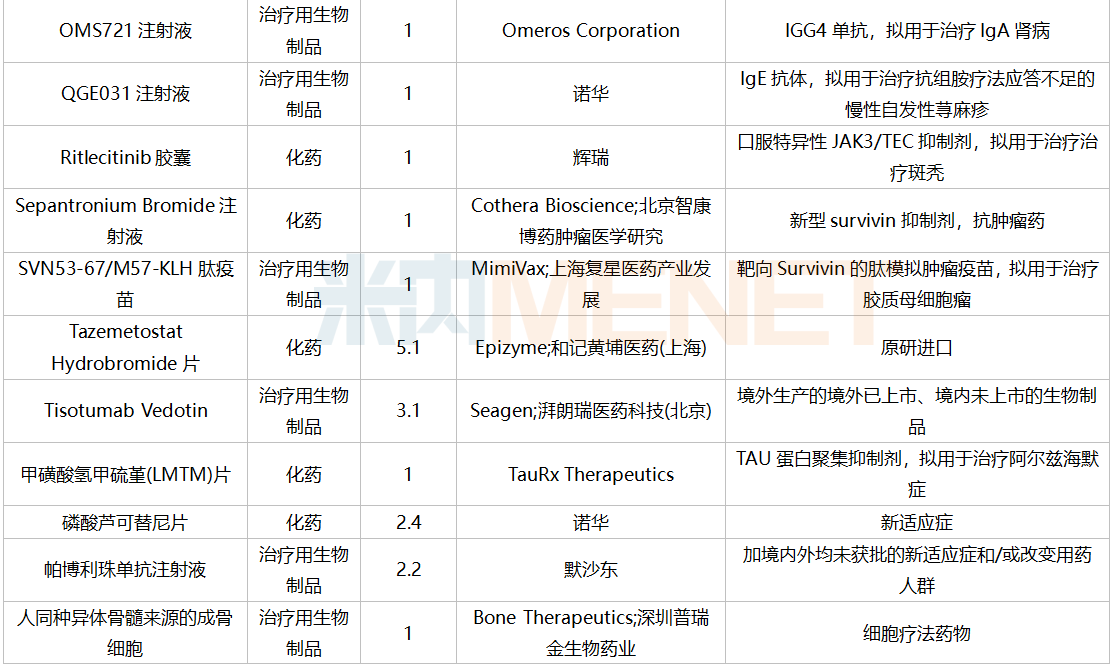
2021年12月,45个品种的进口申请获CDE承办。其中1类新药有22个,2类改良型新药有5个,5.1类进口原研药有12个,5.2类进口仿制药有4个。其中伏立康唑干混悬剂暂无国内仿制获批。
12月进口上市申请承办情况

12月进口临床申请承办情况
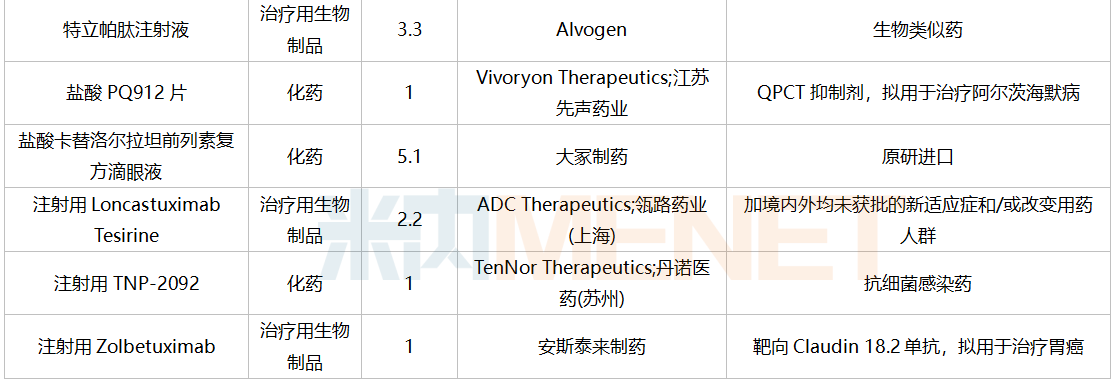
获批情况
2021年12月,再鼎医药的1类新药甲苯磺酸奥马环素片和注射用甲苯磺酸奥马环素获批上市,辽宁海思科制药的环泊酚注射液、江苏豪森药业集团的甲磺酸阿美替尼片以及苏州盛迪亚生物医药的注射用卡瑞利珠单抗为新适应症获批。此外还有基石药业的1类生物药舒格利单抗注射液获批上市。
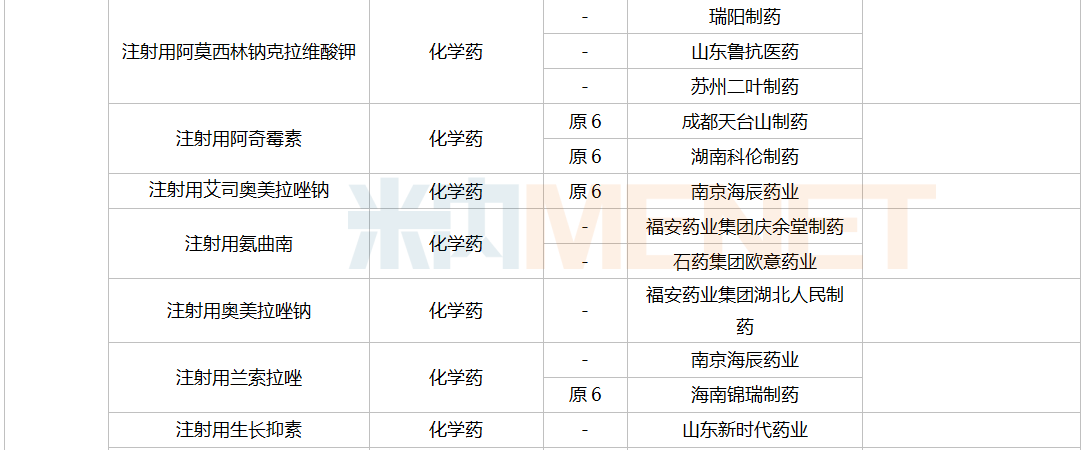
43个仿制药获批(含进口5.2类),富马酸贝达喹啉片、腺苷钴胺胶囊为国内首仿获批。58个存量品种有企业通过一致性评价,其中8个品种首次有企业过评。
12月上市申请品种及一致性评价品种获批情况



 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 110
110

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 98
98

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 87
87