 产业资讯
产业资讯
 药渡
药渡  2022-01-10
2022-01-10
 4290
4290
What Doesn't Kill You Makes You Stronger.” --- 著名哲学家尼采 (FriedrichNietzsche)
那些杀不死你的,终将使你更强大。从2019年至今,新冠疫情给我们的健康和生活带来许多改变和挑战,在医药工作者和新冠肺炎病毒争分夺秒的斗争中,诞生了一个又一个新冠治疗药物,每一个药物都像是黑暗里的一束光,承载了人们在疫情中对生命和健康的渴望和珍惜。
药渡盘点了目前小分子抗病毒药物和新冠病毒中和抗体的研发/批准情况,和大家分享。
PART.01 小分子抗病毒药物
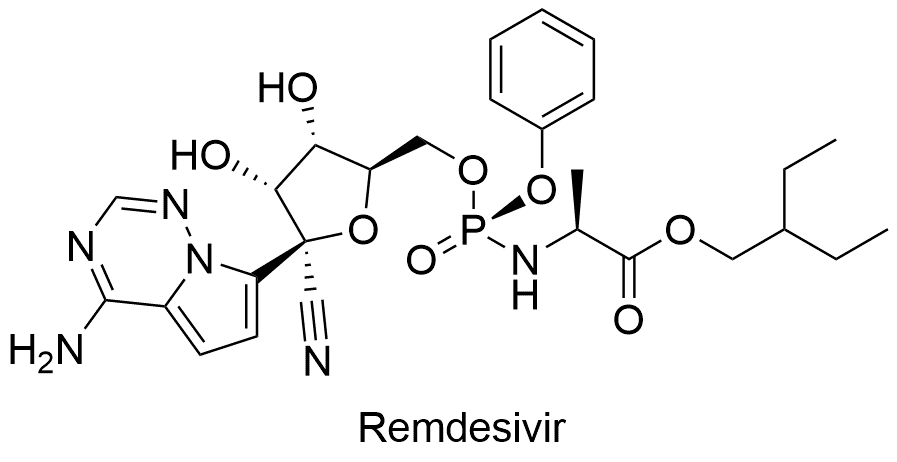
1、瑞德西韦(Remdesivir)
瑞德西韦是全球批准的第一个小分子药物,原研公司为Gilead Sciences,由日本于2020年5月7日率先批准。瑞德西韦是氰基取代的腺苷核苷酸类似物前药,在体内三磷酸化,为RNA依赖RNA聚合酶(RdRp)抑制剂,作为病毒RdRp的底物掺入到到病毒新合成的RNA链中,进而中断病毒基因组的合成,从而达到抑制病毒的作用。在CDC的Covid19Guideline中引用的一项临床试验中(n=1062),相比安慰剂显著缩短恢复时间(10days vs. 15 days; RRR 1.29; 95% CI[1.12–1.49]; P<0.001);第15天,基于量表的临床改善显著高于安慰剂组(OR 1.5; 95% CI[1.2–1.9]; P<0.001);第29天,相比安慰剂组死亡率没有显著差异(HR 0.73; 95% CI[0.52–1.03]; P= 0.07),不良反应为引起恶心、转氨酶升高(转氨酶升高10倍以上需要停药)、凝血酶原时间增加、过敏反应。相比安慰剂SAE的发生率没有统计学差异(25%vs.32%) ,相比安慰剂转氨酶升高的发生率没有统计学差异(6%vs.10.7%)。
2、Molnupiravir
Molnupiravir最初由埃默里大学和乔治亚州立大学发现,2020年RidgebackBiotherapeutics获得了Molnupiravir的商业化权利,专利仍归埃默里大学所有,RidgebackBiotherapeutics随后与默克公司合作推进Molnupiravir用于SARSCoV-2的临床试验。Molnupiravir体内活性代谢物为β-D-N4-羟基胞苷,2021年10月1日,molnupiravir在III期临床中期分析所呈现的数据喜人,因此提前终止,并向美国食品药品监督管理局(FDA)申请紧急使用授权(EUA),2021年11月在英国最先批准,12月在美国、日本和印度分别获批。获批基于的临床试验将主要指标设置为随机分组后29天内住院或病死的患者百分比,结果发现:Molnupiravir组与对照组的病重或死亡率分别为7.3%(28/385)和14.1%(53/377)(p=0.0012)。本次试验中共8名受试者死亡,但全部在对照组。也就是说,molnupiravir将进展为重症或死亡的几率降低了50%,且将死亡率拉低至0%。
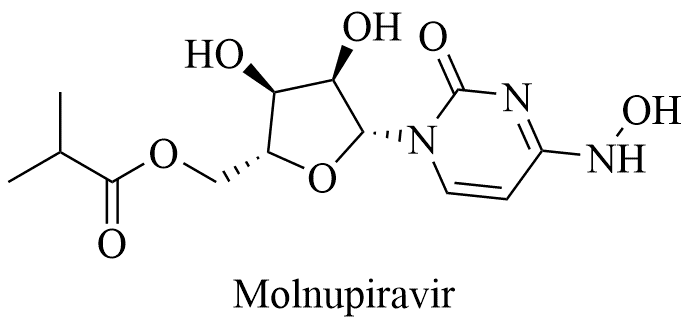
临床试验上Molnupiravir比瑞德西韦更有效,并且体外试验中抑制SARS-CoV-2复制活性高3-10倍,但是定价过高,美国为700美元1疗程,就在1月4日,印度制药公司DrReddy‘s Laboratories Ltd宣布,将推出默沙东(MRK.US)新冠口服药molnupiravir的仿制药,定价为每粒35卢比(0.4693美元)。该仿制药的品牌名为“Molflu”,患者在5天的疗程中服用40粒仿制药,总费用为1400卢比(18.77美元)。
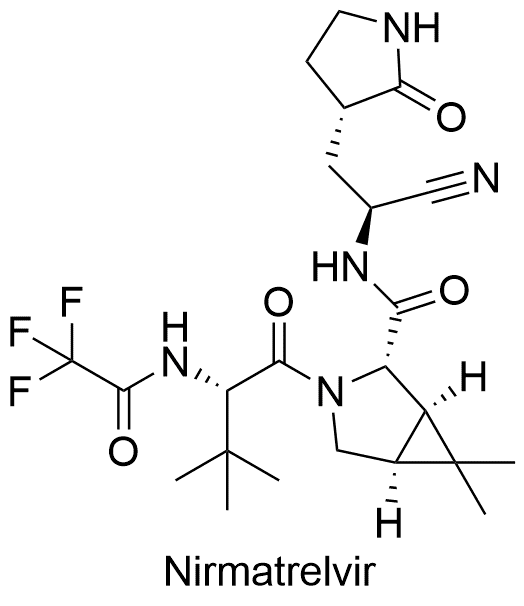
3、Nirmatrelvir/Ritonavir(Paxlovid)
Nirmatrelvir/Ritonavir是辉瑞研发的复方制剂,由2片Nirmatrelvir(PF-07321332)和1片利托那韦组成,商品名Paxlovid。2021年12月22日获得美国FDA紧急授权使用(EUA),用于治疗轻中度新冠肺炎成人和儿童(12岁以上,体重至少40 公斤)患者。Nirmatrelvir通过阻断SARS-CoV-2-3CL蛋白酶活性而阻断病毒复制,利托那韦帮助减缓Nirmatrelvir代谢。3CL蛋白酶是冠状病毒的主要蛋白酶,它在polyprotein的翻译中起着至关重要的作用。
美国FDA 授权此药紧急使用的依据,来源于II/III 期EPIC-HR试验的研究数据,该试验招募了1039名18岁及以上确诊为COVID-19、具有发展成重症高风险的非住院成年患者。结果表明,在症状出现的5天内,接受Paxlovid 治疗的成人与安慰剂相比,与COVID-19 相关的住院或因任何原因死亡的风险降低了88%,并且在治疗组中没有观察到死亡。治疗组和安慰剂组出现不良事件的程度相当,其中大部分是轻微的。
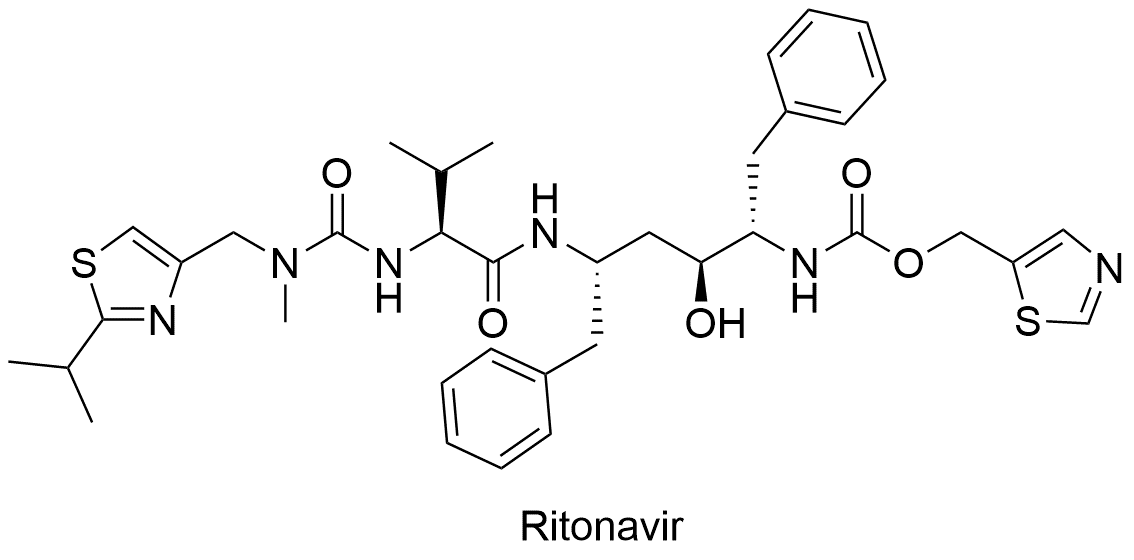
更多小分子抗新冠病毒药物见下表:

(图片来源药渡数据)
PART.02 新冠病毒中和抗体
1、Bamlanivimab/Etesevimab
Bamlanivimab是一种针对SARS-CoV-2刺突蛋白的强效、中和性IgG1单克隆抗体,研发代号为LY-CoV555,是2020年3月12日礼来与加拿大公司AbCellera合作获得。LY-CoV555于2020年6月2日进入临床研究,是全球首个进入临床的新冠病毒中和抗体。Etesevimab是一种重组全人源单克隆中和抗体,由君实生物与中国科学院微生物研究所共同开发,礼来从君实引进了Etesevimab,君实生物继续主导大中华地区的开发活动,礼来主导全球其它地区的开发活动。
美国的EUA基于2021年1月26日宣布的BLAZE-1试验的3期数据。BLAZE-1研究是一项随机、双盲、安慰剂对照的2/3期临床研究,旨在评估Bamlanivimab单独使用以及和Etesevimab的双抗体疗法在门诊治疗有感染症状的COVID-19患者的有效性和安全性(n=1035)。试验结果显示Bamlanivimab和Etesevimab联用相比对照组降低COVID-19住院和死亡风险降低70%(p=0.0004)。治疗组不良事件发生率为2.1%(11例),安慰剂组不良事件发生率为7.0%(36例)。试验达到主要研究终点。
2、Sotrovimab
Sotrovimab是新冠病毒中和抗体,为重组人源免疫球蛋白,它与新冠病毒刺突蛋白(S)的受体结合结构域(RBD)上一个高度保守的表位结合,使用Xencor‘sXtend™ Fc技术增加肺部生物利用度,由VirBiotechnology与GlaxoSmithKline合作开发。2021年5月26在美国获得紧急使用授权,2021年8月26日在澳大利亚治疗用品管理局(TGA)获得临时批准,2021年12月17日获得欧盟批准,并在加拿大、埃及、意大利、韩国、巴西、科威特、卡塔尔、新加坡和阿拉伯联合酋长国获得临时授权。
Sotrovimab的批准基于COMET-ICE临床试验(NCT04545060)第1/2/3期数据的中期分析的回顾,这是一项随机、双盲、安慰剂对照临床试验,在第29 天的全因住院超过24 小时或因任何原因的相对死亡率(调整后)相比安慰剂显著降低79%[95% CI(50%-91%)],达到试验的主要终点[2]。2021年3月,Vir和GSK联合宣布,基于积极的中期分析结果,独立数据监督委员会(IDMC)建议提前终止III期临床试验。Sotrovimab的持续评估显示其保留了对当前流行的SARS-CoV-2 病毒和各种变体的活性(包括:Alpha(B.1.1.7)、Beta(B.1.351)、Delta(B.1.617.2)、Epsilon(B.1.427/B.1.429)、Gamma (P.1)、Iota(B.1.526)、Kappa(B.1.617.1) 和Lambda (C.37),以及来自布里斯托尔(B.1.1.7+E484K) 和喀麦隆 (B.1.619) 的新变体)。
03、安巴韦单抗/罗米司韦单抗
安巴韦单抗/罗米司韦单抗(BRII-196/BRII-198),是由腾盛博药,清华大学和深圳市第三人民医院联合研发。2021年12月8日正式获得国家药品监督管理局(NMPA)批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40kg)新型冠状病毒感染(COVID-19)患者。其中,青少年(12-17岁,体重≥40kg)适应症人群为附条件批准,暂无临床试验数据,有效性和安全性尚待进一步最终确证。
在对众多人源特异性单克隆抗体与新冠病毒结合能力及结合区域进行了详细分析之后,确定了一对活性最高、互补性超强的中和抗体,它们就是安巴韦单抗/罗米司韦单抗的前身P2C-1F11/P2B-1G5,其中P2C-1F11与新冠病毒上的S蛋白结合后,会促进S1部分快速从新冠病毒上脱落,进而导致新冠病毒无法进入细胞内部。采用腾盛华创抗体改造技术,在P2C-1F11/P2B-1G5的Fc段改造YTE(M252Y/S254T/T256E [YTE]),从而使得半衰期从21天延长到46-76天。
安巴韦单抗/罗米司韦单抗获批基于一项全球多中心、随机、双盲2/3期临床研究ACTIV-2,2021年8月25日,腾盛博药发布中期分析数据显示,与安慰剂组相比,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低78%(P值<0.00001);12月5日发布的三期最终分析数据显示,安巴韦单抗/罗米司韦单抗治疗组患者的住院及死亡风险降低80%(P值<0.00001),治疗组受试者在28天的治疗期内无死亡病例,而安慰剂组有9例死亡。
更多新冠病毒中和抗体药物见下表:
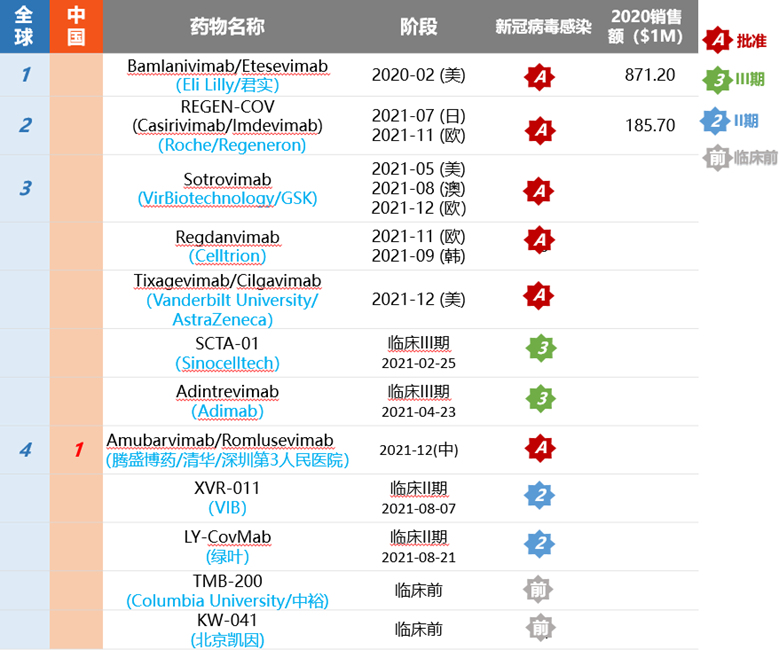
(图片来源药渡数据)

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 99
99

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 89
89

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 78
78