 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2022-05-31
2022-05-31
 2806
2806
前言
美国东部时间2022年5月26日,美国临床肿瘤学会(ASCO)2022年会摘要在线发布,其中多款国产CAR-T细胞治疗产品惊艳亮相,产品适应症覆盖血液瘤与实体瘤,靶点选择多元化,技术路线各有千秋,整体呈现出3D立体的差异化布局,展现了国产CAR-T研发管线的强劲实力,下面小编带大家先睹为快(排名不分先后,如有遗漏欢迎补充)。
复发/难治性多发性骨髓瘤

在治疗复发/难治性多发性骨髓瘤赛道上,原启生物的OriCAR-017产品采用了靶向GPRC5D的二代CAR分子设计,在此基础上添加了其独有的Ori元件,以此来增强细胞的扩增性和持久性。GPRC5D是一种C型7次跨膜受体蛋白,主要在MM患者的恶性浆细胞上表达。在这项I期研究中,OriCAR-017在RRMM患者中显示了良好的安全性和显著的疗效,大部分的AEs是暂时的和可控制的,100% ORR和100% MRD阴性率以及良好的安全性支持OriCAR-017成为一种具有竞争力的RRMM治疗方法。值得注意的是,之前BCMA CAR-T治疗复发的患者仍可受益于OriCAR-017。

与GPRC5D新靶点相比,老牌靶点BCMA/CD19联用的CAR-T在治疗RRMM方面也宝刀不老,基于亘喜FasT平台快速制备的BCMA/CD19双靶点CAR-T展现出了深度且持久的响应率以及高MRD阴性率,安全性良好。截至2022年1月26日,共评估了28例患者(中位随访时间6.3个月,1.8-29.9)的疗效,DL1剂量ORR为100% (2/2),DL2剂量ORR为80% (8/10),DL3剂量ORR为93.8%(15/16),100%的MRD可评估患者(27/27)达到MRD阴性水平,28名患者中有1名未能得到评估。目前GC012F正在被研究用于早期治疗路线以及另外的适应症。
实体瘤

Claudin18.2(CLDN18.2)是一种很有前景的治疗靶点,通常局限于胃粘膜紧密连接处表达,但在胃/胃-食管交界处(G/GEJ)癌中经常过表达。科济药业的CT041是一款靶向CLDN18.2的CAR-T细胞疗法,在临床前研究中显示出良好的抗肿瘤活性。本次临床试验结果共入组14名患者,其中有8例(57.1%)达到部分缓解(PR), 2例(14.3%)患者病情稳定(SD),中位随访时间为8.9个月(95%CI5.91, NE),中位无进展生存期(PFS)为5.6个月(95%CI 1.9, 7.4),中位总生存期(OS)为10.8个月(95%CI 5.1, NE),末次随访时有尚7例患者存活。这些初步结果表明,CT041在既往接受过治疗的晚期G/GEJ癌患者中具有可管理的安全性/耐受性和良好的疗效。目前CT041的II期临床试验正在进行中。

南京凯地生物构建了一种新型的双特异性CAR-T细胞(KD-496),它能同时识别NKG2D配体和CLDN18.2,并且在体外和体内显示出卓越的抗肿瘤疗效和安全性,其中体内数据来源于患者的PDX模型。KD-496 CAR分子采用了CD8铰链区和跨膜区,4-1BB共刺激结构域以及CD3ζ结构域。值得注意的是,KD-496 CAR在体内更有效地消除了异种移植瘤,并且在治疗小鼠过程中没有表现出显著的治疗相关毒性,供试器官未见明显病理改变,该结果为将来KD-496 CAR在治疗GC患者的临床试验提供了临床前数据支持。

CAR-T细胞治疗在恶性血液病中显示了显著的临床疗效,但在实体肿瘤中疗效受限。斯丹赛生物的GCC19 CAR-T产品是基于其CoupledCAR实体肿瘤平台的首个临床候选药物,通过将靶向实体肿瘤CAR-T细胞与靶向CD19的CAR-T细胞配对来放大前者CAR-T细胞的增殖和活化,旨在克服传统CAR-T细胞在实体肿瘤中的局限性。GCC19 CART针对的靶点是在70%-80%的结直肠癌转移病灶中表达的鸟苷酸环化酶-C (GCC)。在两个剂量组中总有效率(ORR)为28.6%(6/21),其中剂量1的ORR为15.4%(2/13),两名受试者表现出部分响应(PR),另外3名疾病稳定(SD)或进展(PD)的受试者在PET/CT上有部分代谢反应(PMR),剂量2的ORR为50% (4/8),4名受试者出现PR(3例在第1个月出现,1例在第1个月出现SD后第3个月出现),另外2名SD受试者在PET/CT上有PMR。GCC19 CART在复发或难治性转移性结直肠癌中显示了有意义的剂量依赖的临床活性和可接受的安全性。

恶性胸膜/腹膜间皮瘤(MPM)是一种侵袭性癌症,其特点是治疗反应低和生存率低,PD-1介导的免疫抑制被认为与实体瘤中T细胞耗竭和功能障碍有关。上海细胞治疗集团构建了一种靶向间皮素并且可以分泌PD-1纳米抗体的CAR-T细胞产品PD-1-mesoCAR-T。6名入组患者的样本间皮素阳性率为50% ~ 100%,其中3例标本PD-L1染色阳性。所有患者在输注前均进行淋巴清除术,有2例(33.3%)患者出现细胞因子释放综合征,分别为1级和3级,4例(66.7%)患者出现发热,2例(25%)患者发生3级肺部感染,5例患者病情稳定大于3个月,1例患者在PET/CT扫描中显示完全缓解,1例患者显示部分缓解。患者的客观缓解率(ORR)为33.3%,而在PD-L1阳性患者的客观缓解率(ORR)为66.7%。对6例恶性间皮瘤患者的临床研究表明,PD-1-mesoCAR-T细胞产品是安全可行的,具有良好的疗效,CAR-T细胞对长期存活的影响将被持续观察。
复发/难治性B细胞急性白血病

靶向CD19的CAR-T细胞治疗产品显示出对r/r B-ALL非常惊人的疗效,然而某些危及生命的副作用,特别是高分级的细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)限制了其广泛应用。为了克服这些限制,精准生物建立了一个基于适度激活和短时间扩展的新型PrimeCAR平台,通过此平台制造的自体CD19 CAR-T细胞产品MC-1-50在临床前研究中显示出较好的疗效和较少的细胞因子分泌。在这项I /II期研究(NCT04271410)中,CAR-T细胞由PrimeCAR平台制造,制造周期缩短到大约2天,T细胞用慢病毒载体转导,其中CAR分子使用了人源化CD19 scFv以及4-1BB共刺激结构域。13名r/r B-ALL患者被纳入本次临床试验,疾病特征和结果见下表:
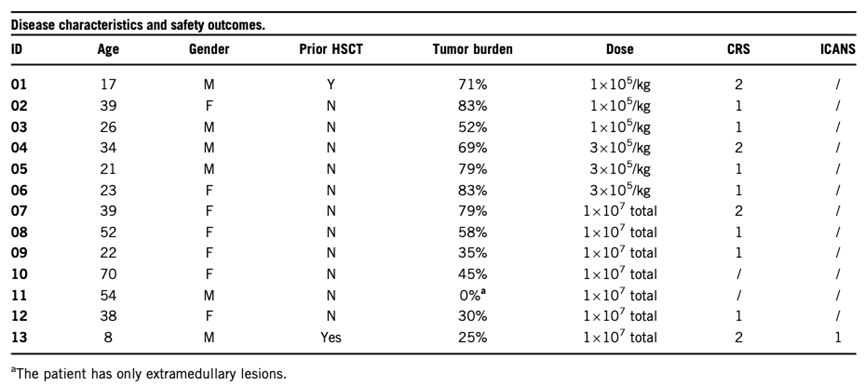
结果显示PrimeCAR平台可以在很短的时间内制备CAR-T细胞,并且具有很高的Tscm比例,在极低剂量治疗r/r B-ALL时具有良好的安全性同时显示出良好的疗效。

自从FDA批准首个CD19 CAR-T细胞治疗产品(Kymriah)用于治疗r/r B-ALL患者以来,细胞因子释放综合征(CRS)一直是危及生命的毒性副作用,严重限制了其治疗潜力。西京医院张娜团队开发了一种降低HPK1表达的CD19 CAR-T细胞产品XYF19,临床前试验显示其具有增强的抗肿瘤活性并且不会诱导高级别的CRS反应。在临床试验(NCT04037566)中入组的11名r/rB-ALL成人患者中,没有病人经历过剂量限制毒性DLT。在XYF19治疗的患者中没有发生3级或更高级别的CRS,而26%Tecartus治疗的患者和72% Kymriah治疗的患者中观察到3级或更高级别的CRS。本研究中未发生神经毒性事件,而Tecartus和Kymriah的神经毒性事件发生率分别为51%和43%。因此XYF19是一种很有潜力治疗成人B-ALL的新疗法。
复发/难治性T细胞急性淋巴细胞白血病


北京博仁医院潘静团队更新了供体来源CD7 CAR-T的临床数据。直到2022年2月14日,20名入组患者中有19名(95%)有响应,中位随访时间为15.8个月(范围13-18.3)。短期不良事件包括3级或更高级别的细胞因子释放综合征(10%)和1-2级移植物抗宿主病(GVHD,60%),但症状都是可恢复的。在5名有响应的患者中发生6起迟发性(输注后30天>)严重不良事件(SAEs)。供体来源的CD7 CAR-T注射后30天的客观缓解率和完全缓解率分别为95%和85%。患者复发的中位时间为6个月(范围4-10.9)。1年无进展生存期(PFS)和总生存期(OS)分别为51.6% (95% CI, 24.7-78.4%)和72.5% (95% CI, 51.9-93.0%)。综合来看,供体来源的CD7 CAR-T细胞产品在治疗r/r T-ALL中显示出令人鼓舞的疗效,但是复发是阻碍长期结果的主要问题。 上述治疗方案会有相当比例的应答患者最终因CD7抗原丢失而复发,因此该团队设计了靶向另一种抗原CD5的CAR-T细胞疗法。超过80%的T-ALL病例细胞中会表达CD5,但是在CD5 CAR-T制备过程中会发生严重的“互杀”现象,因此在对T细胞进行CAR-T修饰的同时也敲除了CD5基因来防止“互杀”现象的发生。5例在CD7 CAR治疗后因CD7阴性复发的患者被纳入研究,所有5例患者在第30天时完全缓解,保持MRD阴性的中位随访时间为2.7(范围为1.8-4.1)个月,CD5阳性健康T细胞的减少是常见的现象,因此需要更长的随访评估来确定持久缓解能力和功能性免疫系统重建问题。

供体来源的CD7 CAR-T对复发/难治性T细胞急性白血病的治疗效果非常显著,但是部分患者会发生移植物抗宿主疾病(GVHD),为了解决这一问题,北京协和医学院赵丽萍团队开发了一种自体CD7靶向的CAR-T细胞疗法。同时为了避免CD7 CAR-T细胞培养过程中的“自相残杀”现象,该团队在CAR-T细胞中引入了CD7 内质网锚定元件,这一设计可以通过降低CD7的细胞膜呈现从而最大限度的降低扩增过程的互杀问题。在入组的5例患者中,细胞因子释放综合征(CRS) 3例,其中1例为3级,中位发生时间为第5天(范围1-9),中位持续时间为4天(范围3-14)。无神经毒性、移植物抗宿主病或感染,5例患者均发生3-4级血液学毒性,30天内恢复至2级。输注1个月后,4例患者获得完全缓解,1例患者脑脊液中仍有白血病细胞。综合来看,自体CD7 CAR-T细胞在治疗r/r T-ALL /LBL患者过程中是安全有效的,没有GVHD发生迹象,但需要更多的病例和更长的随访时间来进一步评价该疗法。
参考资料:https://conferences.asco.org/am/abstracts-posters

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 49
49

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-01
2025-05-01
 50
50

 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-05-01
2025-05-01
 48
48