 产业资讯
产业资讯
 创药网
创药网  2022-07-05
2022-07-05
 2705
2705
本文将近期药物研发新兴靶标进行汇总,涵盖肿瘤、神经精神和心血管疾病领域,这些靶标一般是近期报道的具有一定治疗潜力的新型靶标,以期为科研人员提供参考。
概述
新型靶标的发现是药物研发的关键。本文就近期在国际知名期刊报道的新型药物靶标的研发进展进行汇总(表1),并参考数据库对不同靶标的候选药物研发进展进行阐述。
表1:近期报道的新型药物靶标列举
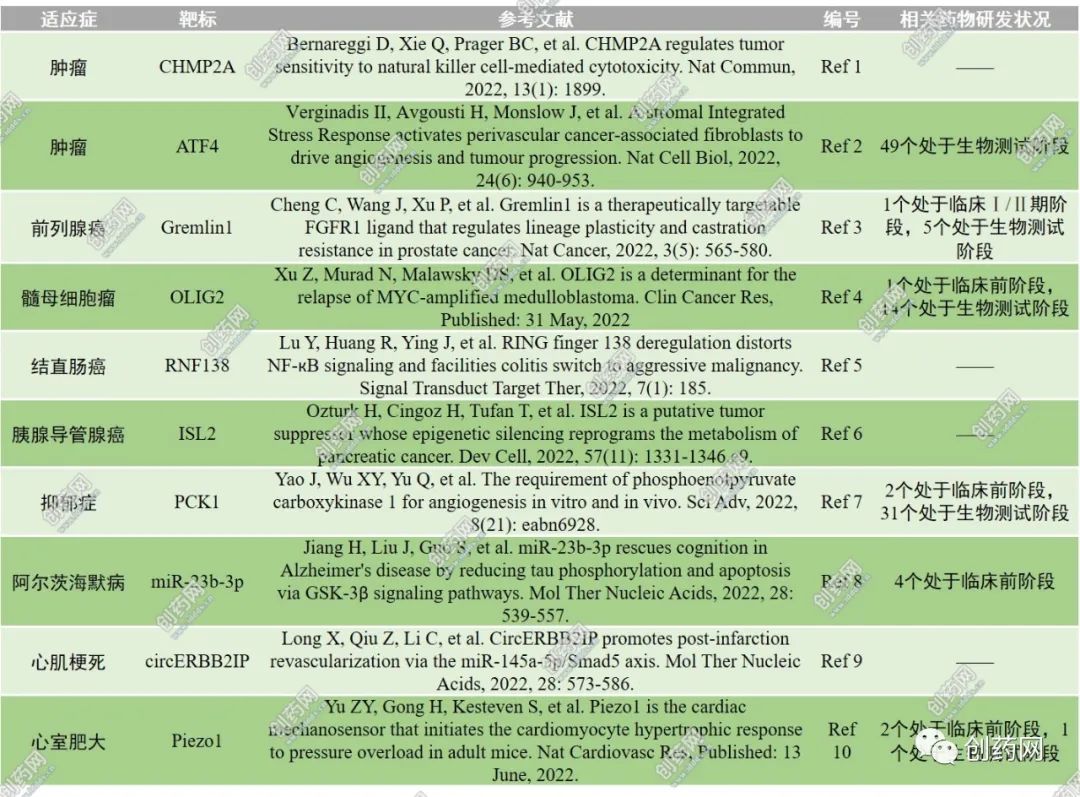
CHMP2A
近期,在Nature Communications杂志上发表了题为“CHMP2A regulates tumor sensitivity to natural killer cell-mediated cytotoxicity”(Ref 1)的文章,其为提高自然杀伤(NK)细胞杀伤肿瘤细胞疗法提供了潜在的新靶标——CHMP2A。该研究通过在胶质母细胞瘤干细胞(GSC)1517、387、CW468和D456这四个GSC细胞系上慢病毒感染全基因组CRISPR-Cas9文库,并与NK细胞共培24小时后,鉴定出25个可能帮助肿瘤获得耐药性的基因。这些基因中,CHMP2A作为排名第一的能提高GSC耐药性的基因。CHMP2A是ESCRT-III蛋白的一个亚单位,参与了细胞外囊泡(EVs)的分泌。在头颈部鳞状细胞癌(HNSCC)小鼠模型的体内实验中,也证实了CHMP2A在促进HNSCC Cal27细胞对NK细胞介导的杀伤存在抵抗的作用。该研究还发现CHMP2A通过促进肿瘤分泌EVs从而引发NK细胞的死亡,CHMP2A KO或者使用抑制剂替吡法尼(Tip)都可减少EV的分泌,进而增强NK细胞对肿瘤的杀伤效应。此外,研究还进一步发现EV膜上带有MICA/B和TRAIL等配体蛋白,可通过和NK细胞表面的NKG2D和TRAIL-R结合来诱导NK细胞凋亡,因而,用MICA/B和TRAIL的阻断抗体处理可降低EVs对NK的抑制作用。
ATF4
近期,在Nature Cell Biology杂志上发表了题为“A stromal Integrated Stress Response activates perivascular cancer-associated fibroblasts to drive angiogenesis and tumour progression”(Ref 2)的研究论文,其发现在多种肿瘤中高表达的应激蛋白ATF4能通过成纤维细胞促进肿瘤生长,而在成纤维细胞中敲除ATF4,能显著抑制肿瘤血管生成和肿瘤生长,延长癌症小鼠模型的生存期,且无明显副作用,提示成纤维细胞中的应激蛋白ATF4可能是癌症治疗的良好靶标。综合应激反应(ISR)是一种进化上保守的机制,促进细胞对来自肿瘤微环境压力的适应。其中,ATF4是线粒体应激调控的关键基因,参与抗氧化反应、自噬、氨基酸生物合成和转运的基因转录。在缺乏ATF4的小鼠中,癌症相关成纤维细胞(CAF)的激活生物标志物出现缺陷,I型胶原蛋白的表达和生物合成,以及关键促血管生成细胞因子的分泌显著降低,从而导致大量肿瘤细胞死亡。在人类胰腺癌和黑色素瘤患者来源的肿瘤组织中,ATF4活性标志物与I型胶原蛋白生成标志物之间存在显著的正相关,而在黑色素瘤病例中,I型胶原蛋白分泌水平与生存率之间存在显著的负相关。这些发现证实了ATF4基因是癌症相关成纤维细胞的功能、肿瘤恶性进展和转移的关键驱动因素。此外,研究还发现ATF4的敲除对动物具有良好的耐受性,仅导致其体重轻微和短暂的减轻,且没有发现明显的病理异常。
Gremlin1
近期,在Nature Cancer杂志上发表了题为“Gremlin1 is a therapeutically targetable FGFR1 ligand that regulates lineage plasticity and castration resistance in prostate cancer”(Ref 3)的研究论文,其发现了前列腺癌治疗新靶标Gremlin1,并揭示了分泌蛋白Gremlin1作为FGFR1的新型配体,通过FGFR1/MAPK信号通路调控肿瘤细胞可塑性、促进去势抵抗性前列腺癌发生发展以及Gremlin1特异性抗体的应用治疗研究。该研究证实Gremlin1在去势抵抗性前列腺癌中特异性的高表达,而该蛋白的转录表达到雄激素受体(AR)的直接反向调控。Gremlin1可在体内外有效促进前列腺癌在雄激素剥夺的环境中发生发展。同时,研究发现Gremlin1的异常表达可影响肿瘤细胞的可塑性,从而使得肿瘤细胞能够更好地应对环境改变(比如雄激素水平降低)对它们所造成的威胁。在机制方面,Gremlin1蛋白可激活FGFR1,进而磷酸化ERK/MEK信号转导途径。应用FGFR1或者MAPK信号通路的拮抗剂则能拮抗Gremlin1对前列腺癌的促进作用,而BMP配体或是BMP受体拮抗剂则不能干扰该蛋白对肿瘤细胞的影响。在该研究中,使用苏州创胜医药集团有限公司开发的Gremlin1特异性抗体和前列腺自发瘤转基因小鼠模型以及人源性肿瘤组织移植模型,在体内验证Gremlin1特异性抗体对前列腺癌的治疗作用。结果发现,Gremlin1可有效缓解前列腺癌进展,并在与恩杂鲁胺联合应用时有更加显著的治疗效果。该研究为靶向治疗去势抵抗性前列腺癌提供了新型候选药物,具有重要的临床转化意义。
OLIG2
髓母细胞瘤(Medulloblastoma,MB)是儿童中最常见的恶性脑肿瘤之一。转录组学分析显示,髓母细胞瘤分为四类:SHH类、WNT类,Group 3类(MYC类)和第四类(Group 4)。其中,Group 3的髓母细胞瘤主要和MYC高度表达有关,是最恶性的儿童脑瘤,也是预后最差的一个亚型,总生存率低于50%。2022年5月31日,在Clinical Cancer Research杂志上发表了题为“OLIG2 is a determinant for the relapse of MYC-amplified medulloblastoma”(Ref 4)的文章,发现OLIG2是一种生物标志物,是带有MYC扩增的髓母细胞瘤高危亚群的有效治疗靶标,OLIG2抑制剂与放射治疗相结合是针对这种疾病的有效新疗法。在该研究中,通过利用带有MYC扩增的髓母细胞瘤患者来源的异种移植(PDX)小鼠模型规避了在患者身上无法对残留肿瘤细胞无法采样分析的问题。研究发现带有MYC扩增的髓母细胞瘤PDX肿瘤分为两个亚组:高表达OLIG2的肿瘤和不表达或低表达OLIG2的肿瘤;高表达OLIG2的肿瘤对放疗不敏感,放疗后复发,而不表达OLIG2的肿瘤对放疗敏感,放疗后很少复发。在Group 3和SHH的患者中,OLIG2患者的不良预后显著相关。此外,研究还显示通过灌胃给药OLIG2的小分子抑制剂CT-179显著抑制高表达OLIG2的髓母细胞瘤的生长,且通过鞘内直接注射CT-179到小脑髓池,联合放疗,显著抑制了颅内髓母细胞瘤的生长、延缓了肿瘤的复发。该研究为探索更全面、基于分子分型的儿童髓母细胞瘤个体化治疗提供了重要的思路,为CT-179作为高危髓母细胞瘤患者的辅助治疗的潜力提供了强有力的证据。
【参考资料】
1. 科睿唯安CDDI数据库, 检索日期: 2022年6月29日.
2. 科睿唯安Cortellis数据库, 检索日期: 2022年6月29日.
3. 学术经纬、药明康德、健康界、生物谷、BioArt等公开网络资源.

 产业资讯
产业资讯
 识林
识林  2025-05-08
2025-05-08
 36
36

 产业资讯
产业资讯
 阿基米德Biotech
阿基米德Biotech  2025-05-08
2025-05-08
 41
41

 产业资讯
产业资讯
 研发客
研发客  2025-05-08
2025-05-08
 40
40