 产业资讯
产业资讯
 医麦客
医麦客  2022-09-26
2022-09-26
 2068
2068
2021年,Cytiva 联合英国《金融时报》发布了全球生物制药弹性指数,在政府政策法规、人才库、研发生态系统、生产敏捷性和供应链弹性5个关键支柱方面,对生物制药行业的表现进行了深入分析,并就行业如何塑造更具弹性的未来,提供了明确的建议。
今年,基于成功的指数发布,Cytiva 进一步专注研究其中的一大支柱——政府政策与监管。本次调研采访了全球 500 名高级生物制药高管,展示了在新冠疫情期间,政府对行业的更多参与是如何影响药物审批速度、供应链弹性、以及药物可负担性等领域。
报告指出,全球政府正在以更完善的法规来成就更快的行业发展,医麦客作为国内致力于推动生物医药发展的知名产业媒体,经过对国内近年来新药审评审批法规的发展情况进行整理分析发现,在这一层面上,中国与全球保持着同一步调。
政策“加速”号角早已吹响
一直以来,生物医药行业都备受各级政府的高度重视,同时也受到国家产业政策的重点支持。早在新冠疫情之前,政府就陆续出台了多项法律法规及政策,以规范行业标准。从2015年颁布的《关于改革药品医疗器械审评审批制度的意见》到2016年的《关于解决药品注册申请积压实行优先审评审批的意见》等一系列政策,都为加速审批、支持和鼓励生物医药企业进行基础科学研究和研发创新奠定了坚实的基础,同时这也对我国生物医药行业的发展提供了指导方向,也起到了极大的促进作用。
而谈到政府鼓励医药企业创新的政策,首当其冲便是《关于改革药品医疗器械审评审批制度的意见》中所采取的优先审评创新药、罕见病药、儿童病以及临床急需用药等举措,而且还可以对药品的原辅包(即原料、辅料、包装材料)进行关联审批,这极大缩短了企业审批时间,提高了创新药审批的效率和质量。而除了在审批的流程上对创新药开“绿灯”之外,在权益保护上也进行了专利期保护制度的创新,比如说专利期限补偿,在2017年发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中指出,可对创新药在申请过程中耗费的专利保护时间可进行更进一步的补偿。
因时而动,法规政策加速创新药审批
而近几年在新冠疫情的催生下,国家有关生物创新药的加速政策不断加码。疫情爆发初期,国家药监局在第一时间制定了与国际通行标准相一致的疫苗研发与评价的指导原则,并建立起疫苗药品研发服务和应急审评审批机制,采取研审联动和滚动审评等方法,把审评、核查、检验实行并联,确保药物在上市申请受理时,研发、核查和检验等各项工作同步完成,由此实现了新冠药物获批的“中国速度”。
与此同时,这些举措也同样被用于其他创新药领域。NMPA在2020版的《药品注册管理办法》中推出了突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序四条“快速通道”,用于推动药品研发和上市,这也让更多审评资源投向重大创新、临床急需、临床价值突出和公共卫生急需的药物。药物一旦进入“快速通道”,相应企业将获得更多机会与监管部门进行沟通,还可以向CDE提交阶段性数据并寻求建议。这种政府与企业间的密切协作,无疑可以大幅缩短创新药物的研发与上市周期。
根据今年6月CDE发布的《中国新药注册临床试验进展年度报告(2021年)》中披露,2021年我国药物临床试验登记总量首次突破3000项,其中新药临床试验占比超6成。此外,近三年来我国创新药获批数量连创新高,2019年有14个创新药获得审评通过,2020年有20个创新药获得审评通过,2021年有47个创新药获得审评通过,可以看到我国在药品创新领域迸发的活力,政策加码取得了重大成效。
▲ 2021年中国新药注册临床试验进展年度报告 图片来源:CDE官网
政策发力不止步,未来可期
回顾过去,我国创新药开发已取得可喜的进展,这是药品审评审批制度改革的重大成果。但由于起步较晚,目前我国相关政策体系仍存在短板和不足,在不断完善的同时,也需要持续改进和补充。
为了进一步鼓励创新药物开发,2022年,国内也相继颁布了多项鼓励创新的相关政策,如《“十四五”医药工业发展规划》、《药审中心加快创新药上市申请审评工作程序(试行)》等。在此背景下,我们可以预见,创新药的开发将持续升温。举例来说,仅今年1-7月,作为突破性疗法的中坚力量,国内的细胞治疗领域新增的早期研发管线数量已经超过了120条,而去年全年只有不到60条,这些数据都在表明在国家政策法规的大力支持与推动下,企业创新加速,未来可期。
正如今年《全球生物制药弹性指数》调研报告中针对全球500名制药企业高管进行调研结果显示,达60%的受访者预计未来两年药品审批速度将会加快。
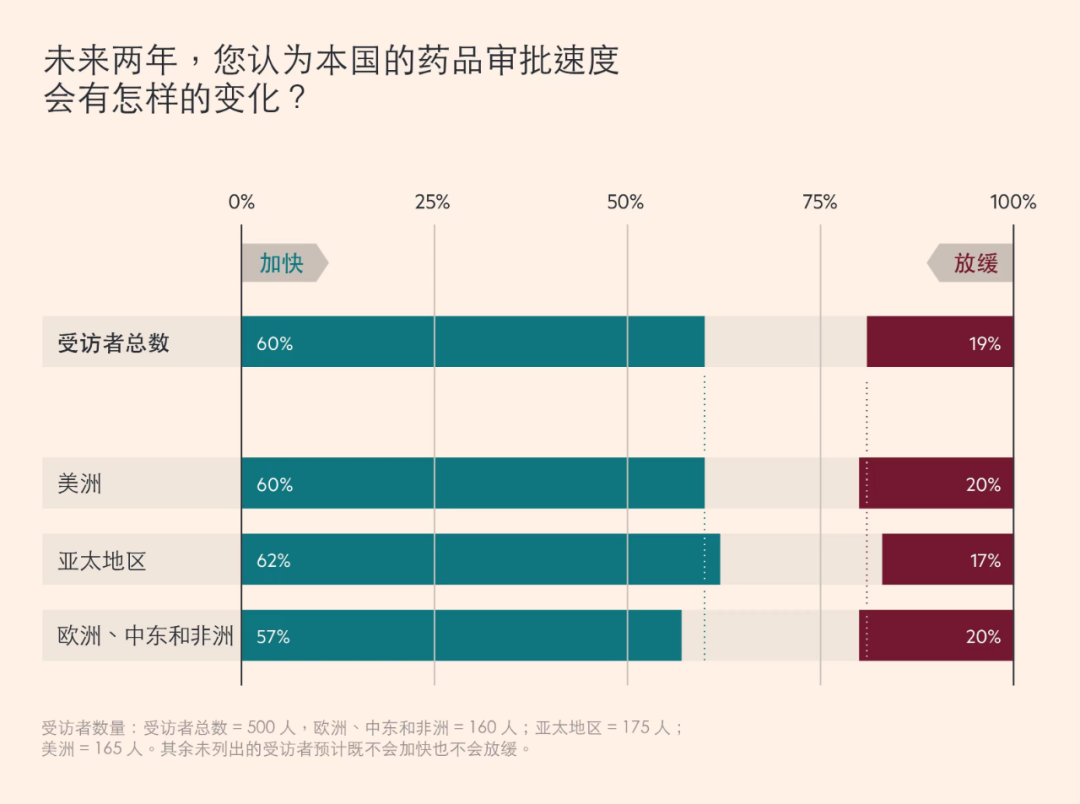
▲ 生物制药公司高管预计,药品审批将会加快 图片来源:FT中文网

 产业资讯
产业资讯
 生物世界
生物世界  2025-05-16
2025-05-16
 74
74

 产业资讯
产业资讯
 动脉新医药
动脉新医药  2025-05-16
2025-05-16
 72
72

 产业资讯
产业资讯
 识林
识林  2025-05-16
2025-05-16
 72
72