 产业资讯
产业资讯
 Insight数据库
Insight数据库  2022-10-09
2022-10-09
 2920
2920
打假背后的资本之手
今年 7 月,世界著名学术期刊 Science 发表了一篇令读者震惊的调查报告。调查报告的题目是:业界的污点?神经科学图像侦探在大量阿尔茨海默病文章中发现了捏造的痕迹,该疾病的奠基性理论岌岌可危!
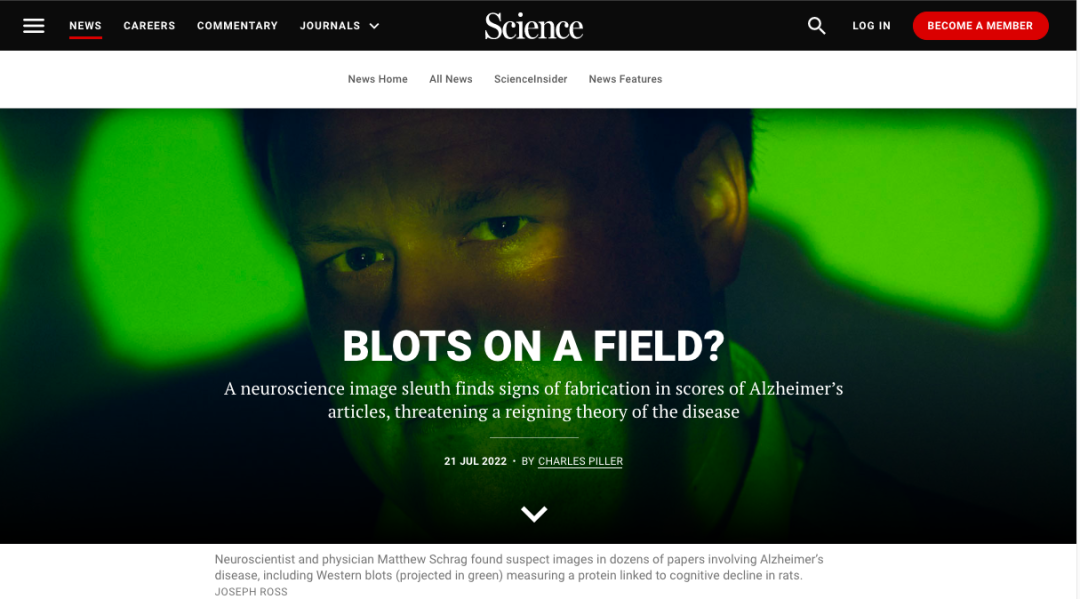
该报告称美国明尼苏达大学神经学家 Sylvain Lesné 在其发表的多篇论文中有超过 70 张图片存在人为篡改的痕迹。而这些论文中包括于 2006 年在 Nature 发表的一篇在阿尔茨海默病领域极具奠基意义的致病机制研究,是在本世纪被引用最多的阿尔茨海默病论文之一。该论文阐述的发现支持了阿尔茨海默病的淀粉样蛋白假说的一个关键要素。
淀粉样蛋白假说认为,脑组织中的 Aβ 团块(称为斑块)是导致此毁灭性疾病的主要原因。Lesné 和他的同事发现了一种 Aβ 亚型,并证明了它会导致大鼠痴呆。但是,如果对 Lesné的学术造假怀疑成立,那么 Lesné的发现就很可能是一个精心设计的海市蜃楼。神经科学的专家们认为该论文可能已经误导了全世界的阿尔茨海默病研究长达 16 年之久。
这一调查报告是应 Science 杂志的要求,由一位资深的独立图像分析师和几位顶级阿尔茨海默病研究人员历时 6 个月之久联手完成的。有趣的是,触发此次调查的是一位名叫 Matthew Schrag,就职于 Vanderbilt University 的并不十分资深的的神经科学家和医生。Schrag 把枪口瞄准 Lesné的论文并非偶然。
2021 年 8 月的一天 Schrag 突然接到一个同事的电话,说是想将他推荐给一位律师。该律师正在调查一种名为 Simufilam 的治疗阿尔茨海默病的在研药物。该药物的开发商 Cassava Sciences 声称它可以通过修复一种蛋白质改善患者认知,这种蛋白质可以阻止 β 淀粉样蛋白 (Aβ) 的粘性脑沉积,而这正是阿尔茨海默病的生物标志物之一。
事实上,该律师受雇于两位令人称奇的客户,他们都是著名的神经科学家,非常了解 Simufilam 的相关研究工作并怀疑其中存在作假,因此看到了通过做空 Cassava Sciences 的股票获利的机会。于是聘请律师对和 Simufilam 相关的研究工作展开调查,尝试揭露 Simufilam 的相关研究存在「欺诈性」,并以此造成 Cassava Sciences 的股票价格下跌。
而恰恰 Schrag 的研究发现也与 Cassava 的一些说法相矛盾。因此,他运用他的技术和医学知识来调查有关该药物及其基础科学研究的已发表的图片,并在数十篇期刊文章中发现了明显更改或重复的图像。
就这样,一个瞄准 Cassava Sciences 股票的枪口同时击中了一位冉冉升起的神经科学家 Sylvain Lesné。我们不得不感叹资本的力量在打假中不可或缺。
造假事件,对 AD 领域影响几何?
虽然当事人 Lesné 尚未对此事做出回应,但是消息一出便在学术界引起轩然大波,学人们纷纷表示这一学术造假事件对该领域影响巨大。然而要想定量或者半定量地定义这一造假事件对阿尔茨海默病临床实践及药物研发的影响并不那么容易。
基于笔者的粗略调研,对于临床实践的影响其实非常有限。其原因在于,涉嫌造假的 Nature 论文中主要的发现是一种叫 Aβ*56 的寡聚体,可以认为是 β 淀粉样蛋白假说的分支之一。而目前业内比较公认的是 Aβ*42 和 Aβ*40 这两个寡聚体。在中国首个阿尔茨海默病痴呆诊疗指南(2020 年版)中,生物标志物检查也只提及了这两个 β 淀粉样蛋白以及 tau 蛋白。
评估其对于药物研发的影响要复杂得多。关于阿尔茨海默病的致病机制,除了 β 淀粉样蛋白假说,学术界还存在胆碱能损伤假说,兴奋性氨基酸毒性假说,神经炎症假说,tau 蛋白过度磷酸化假说,线粒体异常假说,突触损伤假说等等,总计不止 30 个。其中很多假说都有对应的在研药物(见下图)「1」。

截止至 2022 年 1 月 25 日, 基于 clinicaltrials.gov 网站显示的数据,全球共有 143 个阿尔茨海默病在研药物,其中 31 个药物处于临床 III 期,119 个属于疾病改善疗法(disease-modifying therapy DMT)。按照 MoA 分类,在 DMTs 中以 Aβ 为靶点的药物共有 20 个,仅次于神经炎症类药物,名列第 2。而在所有临床 III 期(含处于申报上市阶段)的药物中,以 Aβ 为靶点的药物有 6 个,也算是比较主流的方向。
从新药的 MOA 说开去
虽然阿尔茨海默病目前尚无法治愈,但采取某些药物或非药物手段可减轻或者延缓患者的症状。
目前仅有 5 种药物获 FDA 批准用于改善阿尔茨海默病患者的临床症状,分别是胆碱酯酶抑制剂——多奈哌齐、卡巴拉汀、加兰他敏,谷氨酸受体拮抗剂——美金刚,靶向 Aβ 淀粉样蛋白的抗体——Aducanumab。
Aducanumab 是目前唯一批准上市的基于 β 淀粉样蛋白假说的新药,主要通过将体外产生的抗 Aβ 单克隆抗体应用于阿尔茨海默病患者体内,促进大脑内 Aβ 转移或清除。
另外,2019 年 11 月,重塑肠道菌群的新药甘露特钠胶囊获 NMPA 批准上市,用于治疗轻度至中度阿尔茨海默病,改善患者认知障碍,成为中国原创、国际首个靶向脑肠轴的阿尔茨海默病新药。目前甘露特钠正在开展国际 Ⅲ 期临床试验(登记号:CTR20210187、NCT04520412)。
甘露特钠全球开发进度甘特图
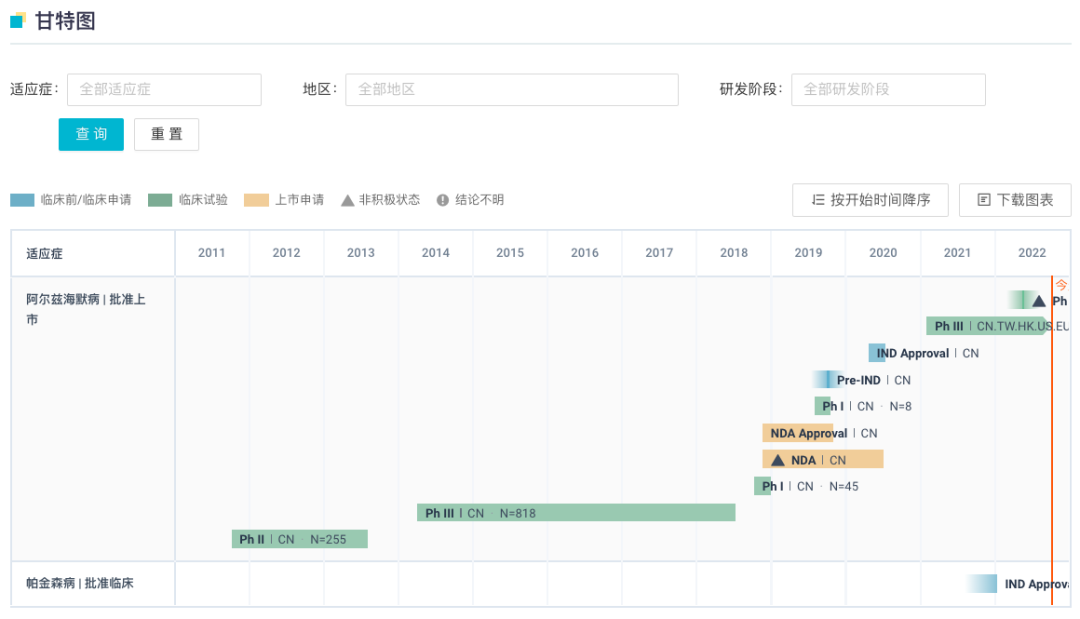
来自:Insight 数据库网页版 (http://db.dxy.cn/v5/home/)在以 Aβ 为靶点的药物中,如果把临床 III 期(含处于申报上市阶段)的 6 个药物作为重点深入挖掘,我们会发现这些药物的作用机制和 Lesné 有争议的科学发现并没有什么直接的关联。这 6 款药物中 Aducanumab(Biogen)是一种高亲和力的全人源 IgG1 单克隆抗体,可以结合 Aβ 的聚合形式,而不是单体。在大脑中,优先结合实体组织中而非血管中的淀粉样蛋白,从而有效地清除脑组织中的斑块。
Donanemab(Eli Lilly & Co),是一种从小鼠 mE8-IgG2a 开发的人源化 IgG1 单克隆抗体。这种生物药物可识别 Aβ(p3-42),一种聚集在淀粉样斑块中的 Aβ 的焦谷氨酸形式。Donanemab 背后的基本原理是,靶向沉积斑块以清除大脑中现有的淀粉样蛋白负荷,而不仅仅是防止新斑块的沉积或现有斑块的生长。
Solanezumab(Eli Lilly & Co)是一种针对 Aβ 肽中间结构域的人源化单克隆 IgG1 抗体。它能够识别可溶性单体 Aβ,而不是纤维状 Aβ。治疗原理是它可以通过隔离 Aβ、改变不同种类 Aβ 之间的平衡以及去除对突触功能直接有毒的小 Aβ 可溶性种类来发挥益处。
Gantenerumab(Roche)是一种全人源 IgG1 抗体。这种抗体的治疗原理是,通过募集小胶质细胞和激活吞噬作用,集中分解和降解淀粉样蛋白斑块。Gantenerumab 优先与聚集的脑 Aβ 相互作用,包括实体组织中的和血管中的。该抗体引发对 Aβ 沉积物的吞噬作用,并能够中和寡聚 Aβ42 介导的大脑长期增强的抑制作用。Gantenerumab 不会改变血浆 Aβ(Bohrmann 等,2012)。
Lecanemab(Biogen, Eisai )是小鼠单克隆抗体 mAb158 的人源化 IgG1 版本,可选择性结合大的可溶性 Aβ 原纤维,可以通过抵消这些原纤维在星形胶质细胞中的病理积累来保护神经元,即降低 Aβ 原纤维毒性(Söllvander 等人,2018 年)。在与抗淀粉样蛋白抗体 aducanumab 和 gantenerumab 的直接比较中,据报道 lecanemab 与 Aβ 原纤维的结合最强,而其它抗体更易结合 Aβ 的更高度聚合物(2021 年 11 月的会议新闻)。
ALZ-801(Alzheon Inc.)是高牛磺酸的前体药物,这是一种以前以曲米沙特和 Alzhemed 名称开发的修饰氨基酸。ALZ-801 在体内转化为高牛磺酸,但比曲米沙特更容易吸收并且在血液中的持续时间更长。据报道,曲米沙特可抑制 Aβ42 聚集成有毒低聚物(Gervais 等人,2007;Kocis 等人,2017)。ALZ-801 和曲米沙特均被代谢为 3-磺基丙酸 (3-SPA),它通常存在于大脑中,可抑制 Aβ42 聚集(Hey 等人,2018 年)。
综上所述,这 6 种热点药物的作用机制虽然都和淀粉样蛋白相关,但是和 Lesné 研究工作中的「重大发现」 Aβ*56 的寡聚体并没有任何关系。换句话说,关于 Aβ*56 的论文如果从来不曾出现,应该也并不会影响这些药物的研发工作。
另一方面,Aβ*56 寡聚体的相关论文的主要发现为以下几点:
在对 Tg2576 转基因小鼠(Ashe 实验室生成的 AD 模型)的分析中,她和同事发现 Aβ*56 与该小鼠品系的认知障碍相关。当记忆问题出现时,Aβ*56 就会出现在他们的大脑中,并且寡聚体水平会随着动物的认知表现而变化(Lesné 等人的 ARF 相关新闻报道,2006)。而较小的 Aβ 种类,包括单体、三聚体和六聚体,在认知障碍之前就已经出现在 Tg2576 小鼠中。
在对人类脑脊液(CSF)分析中,检测到两种寡聚 Aβ 物种(Aβ*56 和 Aβ 三聚体)与老年认知未受损受试者的 tau/ptau 浓度相关,单体 Aβ1-42 与 tau/ptau 浓度不相关。而在患有 AD 或轻度认知障碍 (MCI) 的人中,Aβ 三聚体和 Aβ1-42 均与 tau/ptau 浓度相关(以相反的方式)。这可能表明在衰老和 AD 中观察到的 Aβ 三聚体的浓度升高与异常 tau 变化有关。Aβ*56 和 Aβ 三聚体可能在 AD 的潜伏期(即临床前 AD)启动疾病过程。而 Aβ*56 在 AD 中可能不像在临床前 AD 中那样具有「活性」毒素。随着疾病的进展,tau 变化对寡聚 Aβ 的依赖性降低。
这些发现主要聚焦在寡聚 Aβ 和 tau 蛋白异常的关系上。同时也可能有助于解释为什么抗 Aβ 疗法对有症状的 AD 患者效果欠佳。然而,目前基于 β 淀粉样蛋白假说的在研药物的作用机制主要是消除脑组织中的 Aβ 斑块以及降低具有毒性的寡聚 Aβ 浓度。Aβ*56 是否真实存在并曾被 Lesné检测到似乎并不会撼动 β 淀粉样蛋白假说的根基。
另外,尽管一直以来困难重重成功率低迷,科学家们却从未停止过探寻 AD 领域未知世界的脚步。
值得一提的是,今年 8 月默沙东/Cerevance 宣布达成战略合作协议,将利用 Cerevance 专有的 NETSseq 转录组学技术平台发现治疗阿尔兹海默病的新靶点。该技术可以通过测量大量的基因表达,分析患者大脑中表达过多或表达不足的蛋白,从而揭示神经退行性和精神疾病的生物学途径。
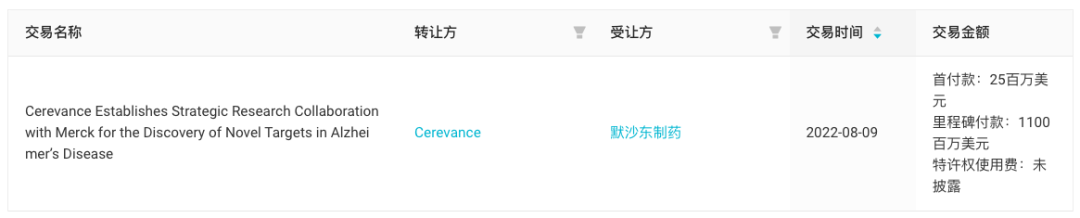
来自:Insight 数据库网页版
9 月 28 日,又一则振奋人心的消息刷屏医药人的朋友圈——卫材/渤健的 Aβ 单抗 Lecanemab 的确证性 III 期临床试验 Clarify AD 研究(试验登记号:NCT03887455)达到主要终点和所有次要终点。该临床实验的结果如下:
III 期临床试验 Clarity AD 最新结果 @Insight 数据库

来自:Insight 数据库网页版 (http://db.dxy.cn/v5/home/)
药物并非唯一答案
受限于其作用机制,目前已经获批及在研药物的作用都仅限于减轻或延缓症状,而不能完全治愈 AD。
海马和新皮质处的突触丢失和神经元凋亡是 AD 典型病理症状之一,也是导致认知功能障碍的主要原因「2」。近年来,关于神经再生的研究非常广泛,神经再生治疗有望通过恢复损伤的神经元和增加神经元数量等改善认知水平,从根本上治疗 AD。
诱导神经再生的干预手段多种多样。目前,国内外研究逐渐开始探索物理干预方法治疗 AD,临床上有两种主要无创无痛的脑电刺激治疗:重复经颅磁刺激(repetitive transcranial magnetic stimulation ,rTMS) 和经颅直流电刺激(transcranial direct current stimulation ,tDCS)。
rTMS 和 tDCS 作为两种新兴治疗 AD 的方法,通过激活中枢神经系统中神经元回路的突触活动,均可在一定程度上提高 AD 患者的认知功能,但它们也存在局限性。电流只能到达大脑皮层,难到达前额叶内侧、岛叶、扣带回等大脑深部区域,其次重复使用 rTMS 也可能会引发癫痫,对人体造成潜在的危害「3」。
近年来,红外光治疗由于产生的副作用小且治疗区域深而逐渐被人们青睐。此外,从红光到红外光范围内的其他波长的光也被证明可以改善 AD 症状。
同时,数字技术成熟度不断提高,例如,传感技术、通信技术、脑机接口、大数据计算、人工智能等。这些技术可能为中枢神经系统疾病领域带来创新疗法。就阿尔茨海默病来说,脑机技术、数字疗法正处于发展初期阶段,或将为 AD 患者带来药物之外的治疗方案。

 产业资讯
产业资讯
 药研网
药研网  2025-08-18
2025-08-18
 105
105
 产业资讯
产业资讯
 一度医药
一度医药  2025-08-18
2025-08-18
 110
110

 产业资讯
产业资讯
 药渡
药渡  2025-08-18
2025-08-18
 111
111