 研发追踪
研发追踪
 医麦客
医麦客  2022-10-24
2022-10-24
 4727
4727
2022年10月19日/医麦客新闻 eMedClub News/--NK细胞疗法开发公司NKGen Biotech近日宣布,美国食品和药物管理局(FDA)已批准其冷冻保存的 "现成的 "异体血源NK细胞疗法(SNK02)开始进行1期、开放标签、剂量递增临床试验研究,以评估对标准护理疗法难治的实体瘤受试者的安全性和耐受性。
NKGen拥有独有专利制造工艺,能生产出数十亿具有高纯度和受体表达水平的NK细胞,而其冷冻保存工艺使细胞能够保持显著的细胞毒性。这使SNK02成为治疗实体瘤的临床试验的理想候选药物。
NKGen生物技术公司副主席Paul Song医学博士称,SNK02是首个冷冻保存的异体NK细胞疗法,与其他细胞疗法不同的是,SNK02在给药前不需要清淋处理。
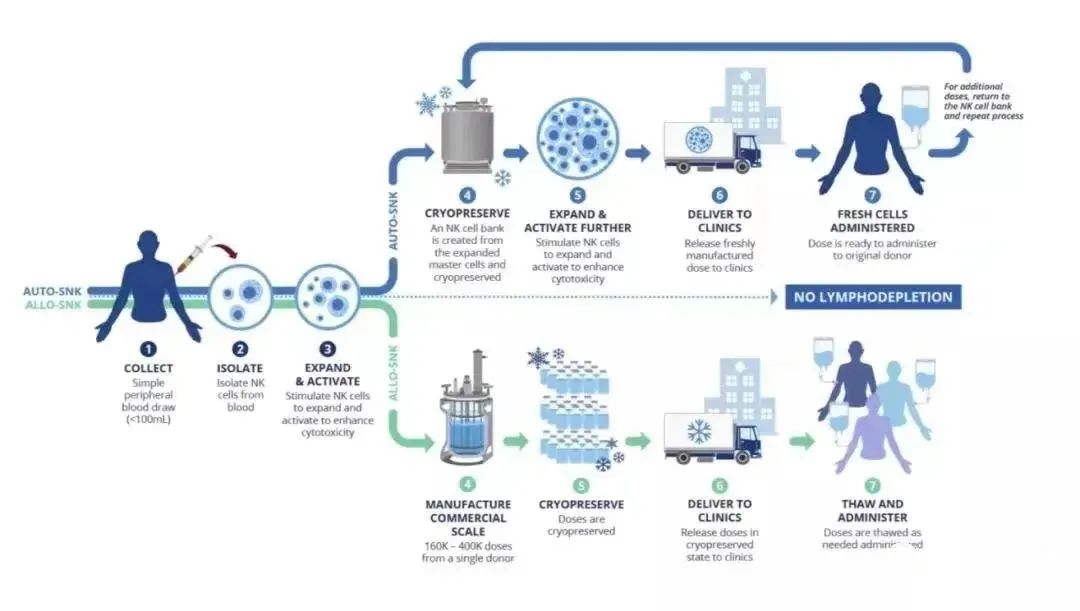
据悉,这是NKGen第二款进入临床的实体瘤NK细胞疗法。其首发产品SNK01是一种自体NK细胞疗法,通过收获患者少量的NK免疫细胞,在体外扩增后将活化的NK细胞回输回患者体内以对抗癌症。
此前,SNK01在2022年世界肺癌大会上公布了与PD-1抑制剂帕博利珠单抗(pembrolizumab)联用,治疗非小细胞肺癌的长达2年的随访数据。
试验结果显示,与帕博利珠单抗单药相比,组合疗法治疗的患者无进展生存期(PFS)显著延长。
试验数据表明,SNK01联合治疗组患者的中位无进展生存期(PFS)为6.2个月,明显优于帕博利珠单抗组的1.7个月;此结果证明组合疗法增强了患者临床治疗的抗肿瘤活性。
此外,2年的长期随访结果显示,联合治疗组生存率为58.3%,PD-1单药组为16.7%,联合治疗组的生存率增长了41.6%。
关于客观缓解率,之前在2020年ASCO大会上曾报道过,联合治疗组的总体缓解率(ORR)为44%,与Keytruda单独治疗的0%相比,明显更高;并且接受最高剂量的NK细胞治疗的患者的ORR可以达到50%。
虽然这只是一项小型研究,但这些初步结果已经表明,与单独使用基于Pembrolizumab的铂类治疗失败的IV期NSCLC患者相比,Pembrolizumab联合NK细胞治疗非常安全,甚至可以降低PD-1相关的毒性,同时增加总体肿瘤反应。
期待在未来,能有更大规模的试验数据来证实这些免疫疗法全新的尝试是否能给患者带来更大生存获益。

 研发追踪
研发追踪
 药研网
药研网  2025-08-14
2025-08-14
 11
11

 研发追踪
研发追踪
 药创新
药创新  2025-08-12
2025-08-12
 106
106

 研发追踪
研发追踪
 药智数据
药智数据  2025-08-12
2025-08-12
 105
105