 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2022-11-03
2022-11-03
 7387
7387
近年来,随着药物研发复杂程度的提升和靶点扎堆状况的加剧,越来越多的研发者意识到,将研发关注点仅局限于某项靶点的数据表现,已无法适应剧烈变化的市场需求;研发者更应该将关注点放在疾病与患者身上,重视患者在药物研发全过程中发挥的作用,才能保障药物能够准确回应真实的临床需求。患者参与药物研发,不仅有助于提高患者依从性和研发成功率,甚至有助于产品上市后取得更好的市场占有率,实现患者-研发者-医药企业的三方共赢,在研发端、供给端、使用端全面推进医药创新产业的发展。“以患者为中心”“鼓励患者参与药物研发全周期”等理念,正越来越多地被创新药研发者重视。在欧美等医药创新先行国家,早已形成一整套完整的指南原则文件,并逐步落地实施。今年以来,我国药品监管部门也已跟进这一趋势,密集出台一系列文件,我国药物研发“以患者为中心”的时代已然开启。
一、先行:患者参与药物研发的国际经验
FDA:以患者为中心的药物开发指南
2012年,美国食品药品监督管理局(FDA)率先发起了以患者为中心的药物开发计划(patient-focused drug development,PFDD)。在2016年颁布的《21世纪治愈法案》(21st Century Cures Act)支持下,PFDD成为FDA的一项优先事项。目前,FDA正在开发4项以患者为中心的药物开发方法指南文件1,涵盖了从数据获取、方案确定、过程推进和结局评估的研发过程。根据进展情况,第一、二项文件已定稿,第三篇的征求意见稿也已发布。
指南1 向预期的患者人群收集准确且有代表性的患者体验数据的方法
指南2 向工作人员和其他利益相关者确定患者指南的重要方法
指南3 确定对患者重要的内容并选择、开发或修改适合目的的临床结局评估数据方法
指南4 如何将临床结局评估纳入监管决策的终点
此外,FDA还发布了“以患者为中心的药物研发路线图”。
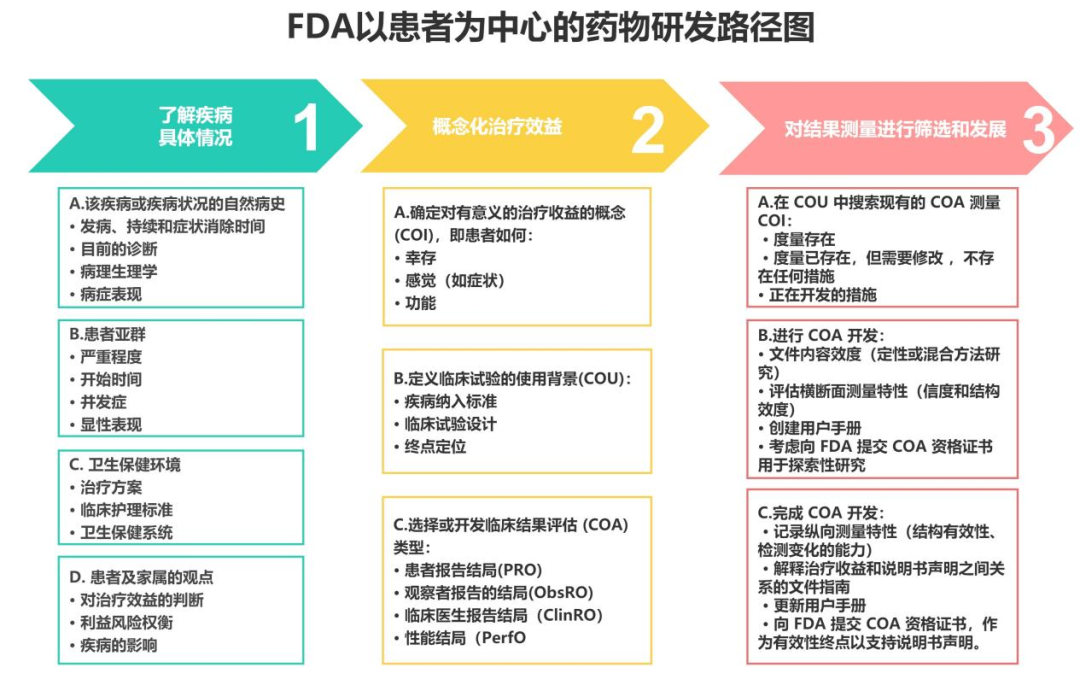
图1 FDA以患者为中心的药物研发路径图2
通过患者为中心开展药物研发的四项指南和路径图,FDA确定了与药物研发过程对应的,从遴选患者、全面沟通病症及患者喜好、选择合适的评估方法到逐步最终将患者数据纳入监管决策的一整套方法。FDA建议申办方尽早落实并在整个医疗产品开发过程中寻求FDA的意见,以确保临床结局评估数据适用于预期的使用环境。
ICH:E8(R1)指导原则中加入患者参与药物研发内容
2017年,ICH启动了ICH E8指导原则的全面更新工作,在E8(R1)中增加了患者参与药物研发的内容,提出了在药物研发过程中,需要倾听患者的意见,获取来自患者的观点。ICH E8(R1)于2021年10月完成了STEP 4并予以通过3。
ICH对患者或患者组织(包括照顾者)进行咨询对药物研发有着非常重要的价值,但也注意到,目前用于识别、收集和分析患者相关数据的方法并不标准或统一,在药物开发或监管决策过程中纳入患者反馈时,会出现的一系列问题。因此ICH E8(R1)对此进行明确:
在研究设计阶段,参与研究的所有主体应为研究质量创建过程提供信息,同时,鼓励研究者尽早与监管机构沟通,特别是当一项研究出现可能影响质量的新关键要素的时候。在选择关键终点指标、确定访视时间点、起草知情同意书等确定关键质量因素的重要环节,需更加重视患者意见以保障试验的顺利实施;
在操作实践阶段,进行可行性方案要充分考虑患者人群的需求,包括医疗实践和患者人群的地区差异等,同时还要及时推进数据的保留和患者随访,确保这些关键因素为研究设计提供信息,以提高研究质量。
EMA:通过“患者偏好”框架2020年3月,欧洲药品管理局(EMA)发布的《2025监管科学战略》,强调了证据生成中要加强患者相关性问题,明确将患者参与临床试验的数据纳入监管决策中。EMA将与人用药品委员会(CHMP)合作,改进患者数据收集方式,也将与卫生技术评估(HTA)机构合作,确定一种互利的方法,促进药物开发中关乎生命质量的患者报告结局(PRO)得以系统使用。
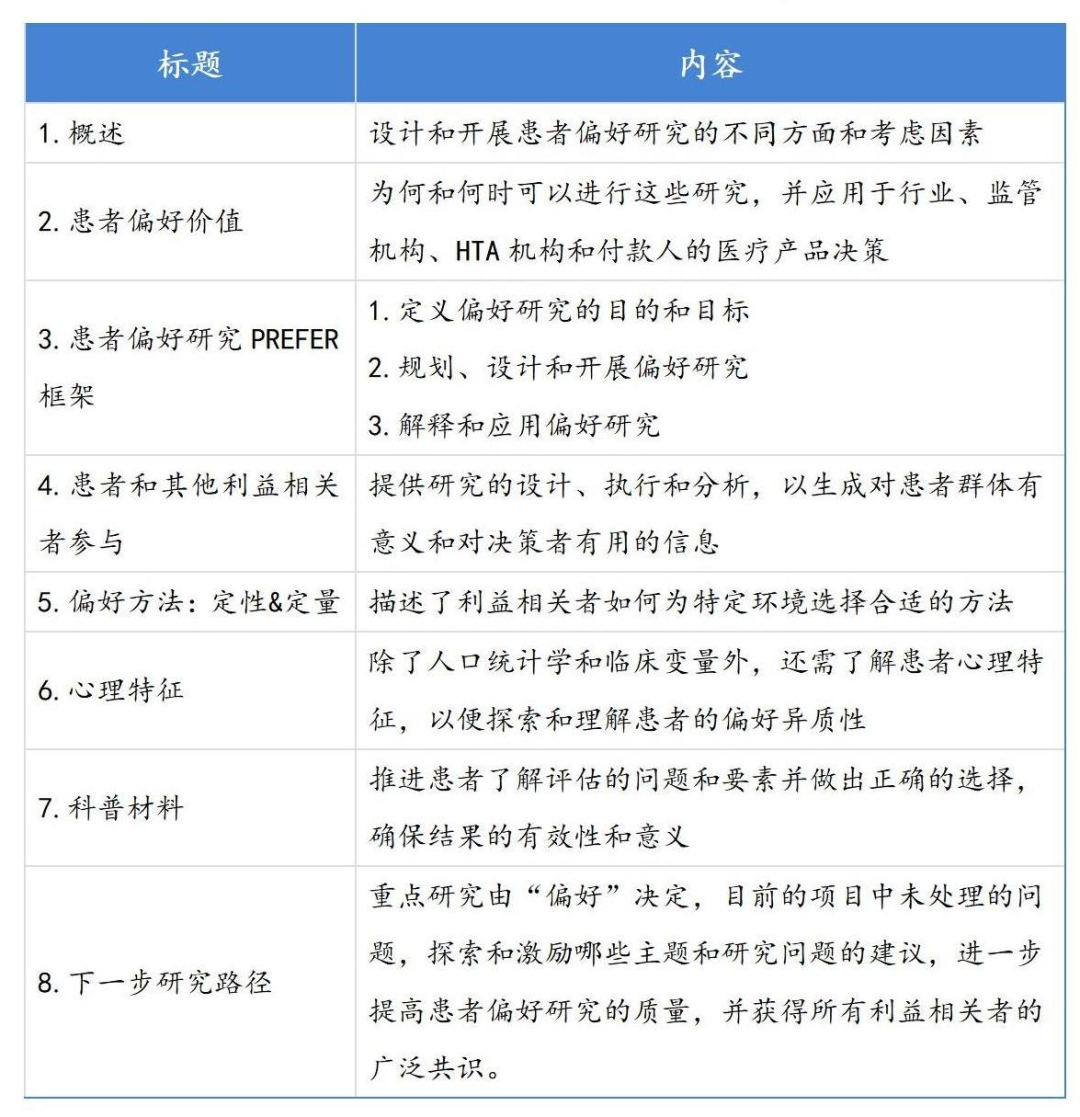
今年6月,EMA批准创新药物计划(Innovative Medicines Initiative, IMI)关于医疗产品生命周期中利益-风险评估中的患者偏好(Patient Preferences in Benefit–Risk Assessments during the Medical Product Lifecycle, PREFER)框架。该框架旨在评估何时及何方式将患者对利益和风险的偏好纳入药品决策4,阐述了药品和器械的申办方应如何利用患者偏好研究来衡量患者观点,并逐步纳入监管决策流程中。
PREFER建议主要由四个步骤组成:利益相关者访谈、偏好方法分类和评估、心理与教育特征方法的识别与评价、前瞻性案例研究。在文件中体现为8个小节,确定了患者偏好研究应如何设计、执行并用于决策。
表 PREFER对在医药研发过程中对患者偏好的评估和使用路径5
二、跟进:我国正在制定中的相关指导原则
今年7月,国家药品监督管理局药品审评中心(CDE)发布了《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》,首次对注册为目的的药物研发全生命周期中的患者参与进行了明确,并鼓励其他的临床研究可进行参考。
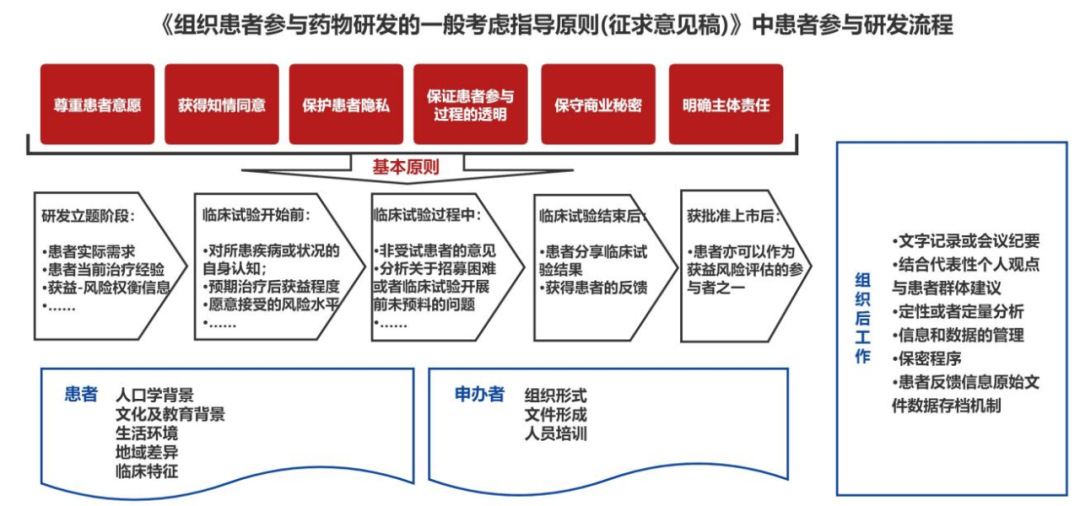
图2 CDE《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》整理
8月,CDE又在一日内连发3项以患者为中心的临床试验相关指导原则(征求意见稿),在监管方面对以患者为中心的药物研发提出相应指导意见,这一系列文件,标志着我国药物研发“以患者为中心”的时代已然开启。
三、讨论:我国患者参与药物研发的关键性问题
临床数据的完整、真实、规范性患者参与药物研发,须有严格的数据管理作为前提。临床试验数据的真实、完整性和规范性是对研究药物的有效性和安全性进行正确评价的基础,而包括FDA在内的国际机构对我国临床数据的质疑,也成了制约我国创新药出海的一大瓶颈。在患者参与的临床试验过程中,还存在着大量在研究中心以外采集的数据或样本,其真实性、完整性和规范性是否已做好了应对稽查的准备,目前还尚存质疑。同时,涉及患者隐私的数据合规问题也值得重视,在伦理审查的过程中患者加入等相关措施尚未成型,患者意见难以保障能够被采纳和执行,并且避免隐私外泄的风险。
如何在科学监管过程中吸纳患者意见ICH管委会主席Theresa MULLIN曾表示,“患者需求是ICH制定指导原则的着力点,未来将专注于起草数据驱动相关指导原则,以更好识别潜在风险,保护患者健康”6。患者参与的相关数据纳入科学监管,需要一整套的相关指导原则的相互推进和配合,增加指南之间互通性,形成一整套科学的监管体系,同时在实践过程中不断充实完善。
患者筛选与教育沟通问题个体患者往往受卫生健康知识信息缺乏、参与试验过程参与方式单一、各类资源掌握程度有限等问题限制,不能充分参与医药研发过程,更好地行使其话语权。因此,如何从人群中选择患者代表,如何让大众理解临床试验的方向,如何将高质量的患者观点纳入终点,成为核心问题,对患者教育、患者组织建设、患者与家属沟通以及相关技术手段的发展提出了更多的要求。
国际合作在更好地推进患者参与药物研发方面,先行国家和组织早已开始了国际合作,FDA和EMA已于2016年成立了FDA-EMA患者参与小组,通过战略合作,共享患者参与药物监管生命周期的最佳实践。根据Pharma Intelligence2012—2017年的数据,美国和欧盟开展以患者为中心的临床试验占比最高,分别为38%和34%,而中国仅为5%7。我国亟须向先行国家学习经验,完善标准建设,促进科学监管和改善决策制定。
四、展望:新理念,新实践,新突破
患者参与药物研发从理念走向实践,需要一系列原则、指南的制定和落地,还需要注重数据收集、记录和呈现方式的革新。随着新技术手段的应用,医疗大数据共享平台,特别是临床研究数字化工具平台在不断建设,患者这一临床研究中的重要主体,才能以更好的方式参与研发过程,实现医药创新更深层次的突破。
在具体实践中,一方面期待在深度上的进一步拓展以患者为中心的内涵,鼓励患者广泛深入地参与到药品管理全生命周期中。例如,拓展患者群体、培育患者组织,在联合治疗、用药策略、伴随诊断方面加入患者声音;另一方面,在广度上拓展更多尝试,例如探索中医药研发过程中的患者深度参与等。
以患者为中心开展药物研发已成为不可逆转的新发展方向,我们期待政策和实践的进一步革新,以适应医药研发的最新变化,对接未满足临床需求,提升医药研发的临床价值,实现患者需求和产业发展的双向奔赴。
中国医药创新促进会 政策研究中心
作者:吴琼文倩 分析师 wuqwq@phirda.com
审核校对:张志娟、刘发鹏
参考资料:
1.FDA Patient-Focused Drug Development Guidance Series for Enhancing the Incorporation of the Patient’s Voice in Medical Product Development and Regulatory Decision Making(2022-6-29)
https://www.fda.gov/drugs/development-approval-process-drugs/fda-patient-focused-drug-development-guidance-series-enhancing-incorporation-patients-voice-medical
2.FDA. Roadmap to patient-focused outcome measurement in clinical trials .(2014-06-01) .https://www.fda.gov/media/87004/download.
3.ICH HARMONISED GUIDELINE GENERAL CONSIDERATIONS FOR CLINICALSTUDIESE8(R1) (2021-10-6)
https://database.ich.org/sites/default/files/E8-R1_Guideline_Step4_2022_0204%20%281%29.pdf
4.PREFER Including the patient perspective (2022-4-19)
https://www.imi-prefer.eu/about/
5.PREFER Recommendations - Why, when and how to assess and use patient preferences in medical product decision-making(2022-4-19)
https://zenodo.org/record/6491042#.YtYHL3ZByUl
6.“凝聚以患者为中心的医药行业合力——ICH助推医药产业更高质量发展”中国药品食品网(2021-5-21)
http://test.health-china.com/c/2021-05-21/789907.shtml
7.The economist intelligence unit. Patient-centric trials]. (2018-06-27)
https://druginnovation.eiu.com/patient-centric-trials/
8.谢静,王焕玲 以患者为中心的临床试验:医药研发新模式 《协和医学杂志》2021年第6期

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 3
3

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 4
4

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 4
4