 产业资讯
产业资讯
 识林
识林  2022-11-15
2022-11-15
 2393
2393
美国 FDA 仿制药办公室(OGD)最近更新了 2022 财年全部仿制药使用者付费(GDUFA)批准和接收数据。2022 财年 FDA 共完成 722 件简化新药申请(ANDA)完全批准,比去年多出 43 件,但也不及前几年,比 2019 财年创造了历史最高批准记录的 935 件更是少了 213 件。原始 ANDA 提交数量为 857 件,所以今年的提交数量再次超过批准数量,GUDFA 到目前为止只有 2019 年一年批准量超过提交量。GDUFA 下 ANDA完全批准、暂时批准和提交量的全面数据如下图所示:

下面我们来看看其它方面的一些数据:
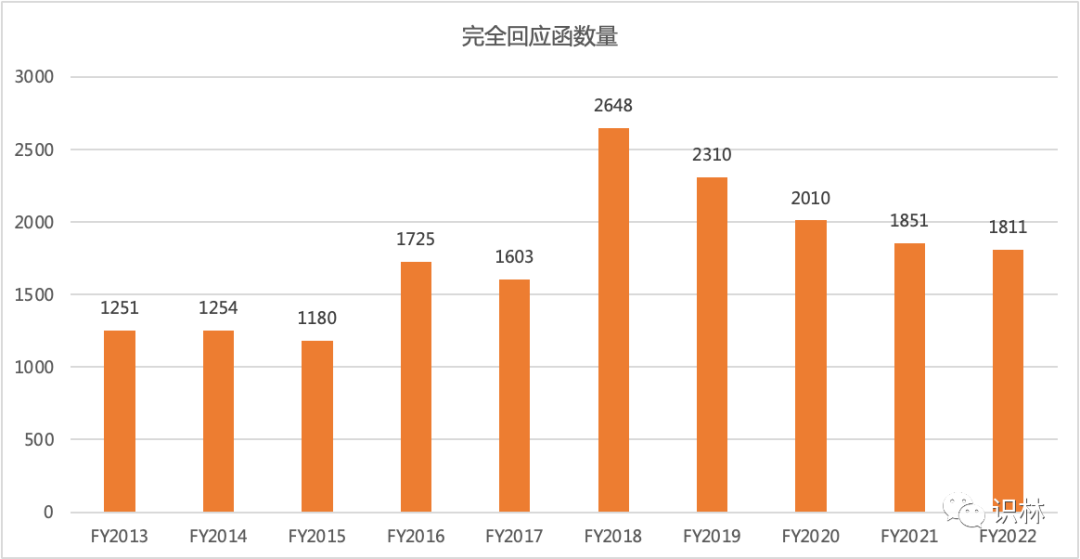
2022 财年 OGD 拒绝接收(RTR)49 件 ANDA 与前两财年一致,完全回应函也继续保持降低趋势 1811 封。
2022 财年的信息请求(IR)数量为 4370 封与 2021 财年的 4313 封差别不到,学科审评函为 2484 封,比 2021 财年增加了约 9%。FDA 从 2018 财年开始,根据 GDUFA II 开始报告 IR 和 DRL 的统计数据。在这四年中,IR 数量最多的一年为 2018 财年,共发出 4,452 份 IR;而 DRL 最多的年份为 2019 财年,共发出 2,997 封。
首轮批准率,OGD 在 GDUFA II 期间开始报告首轮批准情况,在2022 财年的 722 件完全批准中,有 130 件(18%)的完全批准是首轮批准,与 2021 财年的 17.8% 的首轮批准率大致相同。鉴于 FDA 承诺努力改善 GDUFA III 的首轮批准率,这一指标需要在下一个五年 GDUFA 周期中显著提高才能宣告成功。

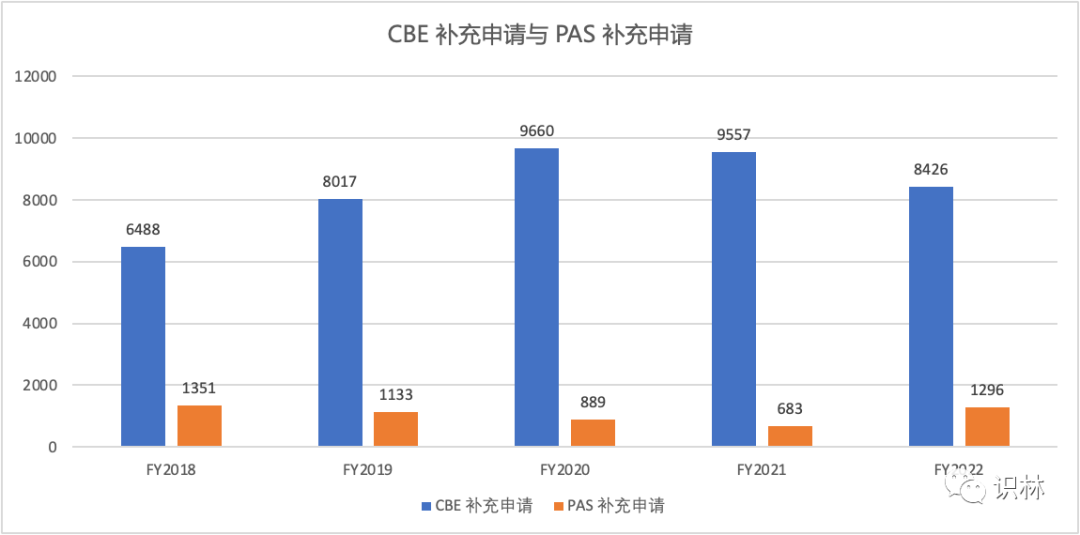
对于生效变更(CBE)补充申请,OGD 在 2022 财年收到 8426 份,在 2021 财年收到高达 9557 份。这可能代表支持 OGD 化学审评的药品质量办公室(OPQ)的工作量放缓。2022 财年收到的需事先批准的补充申请(PAS)总计 1296 份,2021 财年由 1351 份,略有减少。对于许多 PAS 补充申请,需要消耗更多的资源来审评这些补充申请。
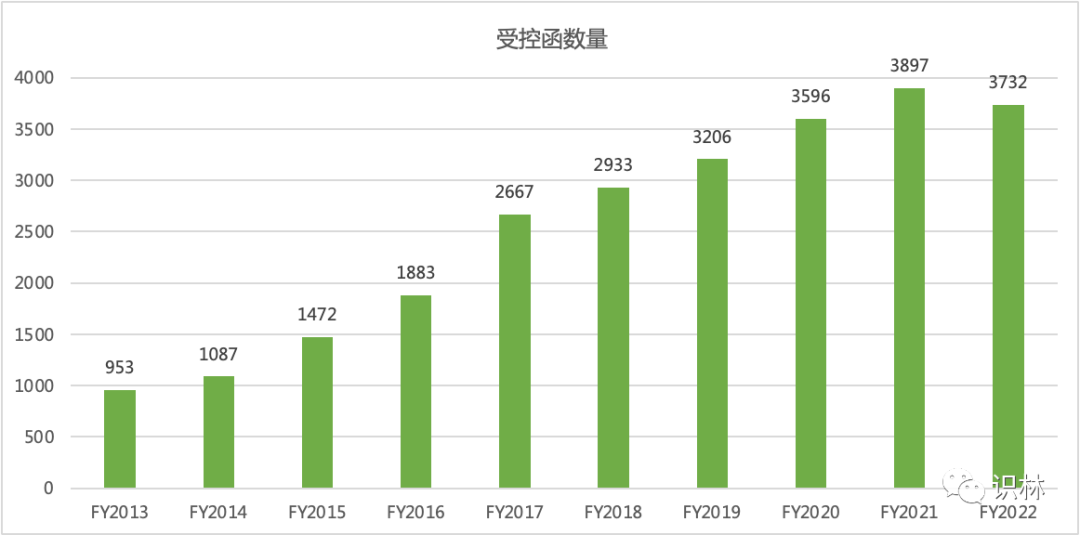
最后,受控函(CC)相关的指标,2022 财年收到 3732 封受控函,虽然比 2021 财年的 3897 封略有下降,但受控函数量仍然巨大,并且需要相当大的资源承诺,因为受控函有目标日期。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 18
18

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 20
20

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 19
19