 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2022-12-09
2022-12-09
 2573
2573
近日(2022年12月7日),在肿瘤药物咨询委员会(ODAC)压倒性投票(14反对:2赞成)反对批准Oncopeptide的PDC药物Pepaxto上市后,FDA遵循了该专家会成员的意见,昨日正式宣布撤销对Pepaxto的加速批准,禁止其在市销售。
Pepaxto是一款靶向氨肽酶(aminopeptidase)的PDC药物。2021年1月26日获FDA加速批准上市,与地塞米松联用于治疗三重难治性/复发性多发性骨髓瘤(R/R MM)。
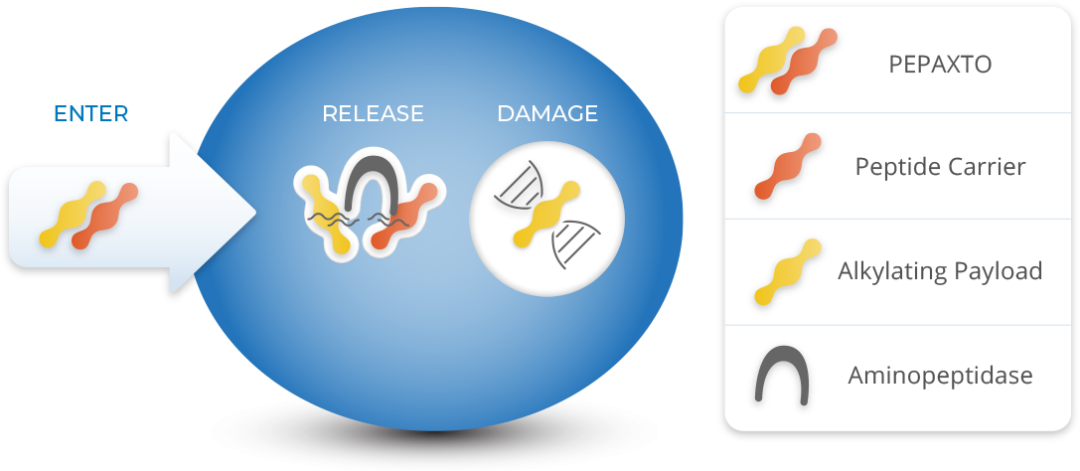
但在获批上市不到半年,Pepaxto的验证性临床试验OCEAN就报告了令人失望的结果。该试验不仅未能达到总生存期(OS)的临床终点,且Pepaxto治疗组患者的死亡人数比对照组更高(总体生存风险比1.104),这个不利的生存风险也导致了FDA立即该临床试验以及其他正在进行的临床试验入组。而FDA本打算在2021年10月28日召开肿瘤药物咨询委员会(ODAC)会议来对Pepaxto的这个风险/受益评估,以决定Pepaxto继续留美销售事宜。不过,Oncopeptides未等到FDA专家会召开前先行做出了自愿撤出美国市场的决定,该司股价受到利空刺激,当天暴跌77%。
去年9月,在IMW上公布的Ⅲ期OCEAN研究最新数据似乎给Oncopeptides带来了重返市场的信心,该试验被宣布达到了无进展生存期(PFS)的主要终点,总缓解率(ORR)为33%,PFS达6.8个月。基于这个临床数据,Oncopeptides又做出了取消了撤回的决定。
但美国监管机构对Oncopeptides对Pepaxto的受益风险抱有质疑,2022年7月20日,FDA再次宣布召开ODAC以对Pepaxto的受益风险进行评估。据FDA审评员Alexandria Schwarsin向ODAC提交的关于OCEAN临床数据的审查文件称,Pepaxto的中位OS比标准护理短,并且对该公司提供的PFS分析后发现,Pepaxto缺乏强有力的治疗效果。Schwarsin指出,考虑到OS损害,任何积极的PFS仍不足以支持其临床获益。一些ODAC成员也持保留意见。ODAC小组成员AndyChen在投出反对票时提出了对Pepaxto的总生存益处的质疑。另外一位投出反对票成员Anthony Sung认为,Pepaxto收益不会超过风险。FDA肿瘤卓越中心负责人Richard Pazdur指出,我们需要的是Oncopeptides提供确切的证据,而不是事后分析。而从Pepaxto的获批适应症来看,在继续将Pepaxto留市的理由已然牵强。近几年,医学进步已经使得多发性骨髓瘤的用药环境得到了大幅改善,治疗手段层出不穷。而Pepaxto疗效优势尚不突出,死亡风险还很高,FDA也很难找出理由将其继续留市销售。
加速批准将加速撤销
Pepaxto的撤市也反映了“加速审批”的艰难撤销弊病开始有所改善。“加速审批”这项新药审批政策最早在1992年确立,旨在根据经过验证的预测临床获益的替代终点或中间临床终点,加快用于治疗未满足临床需求的严重疾病的药物的批准。而获得加速批准的药物需要遵守上市后要求(PMR),确认其临床获益之后可由FDA转为完全批准,否则将撤销加速批准。而对于企业而言,无法按时完成相关验证性临床试验(被推迟)或难以确证临床获益是很普遍的,这些药物却通常仍在市销售。即便验证性临床宣告失败后,FDA也很少能够立即采取撤销监管行动,有些适应症在临床临床实践指南中继续被推荐--即便在制造商选择自愿撤回之后。
18个获加速批准适应症的验证性临床结果公布以及监管行动的时间线(1992-2020年)
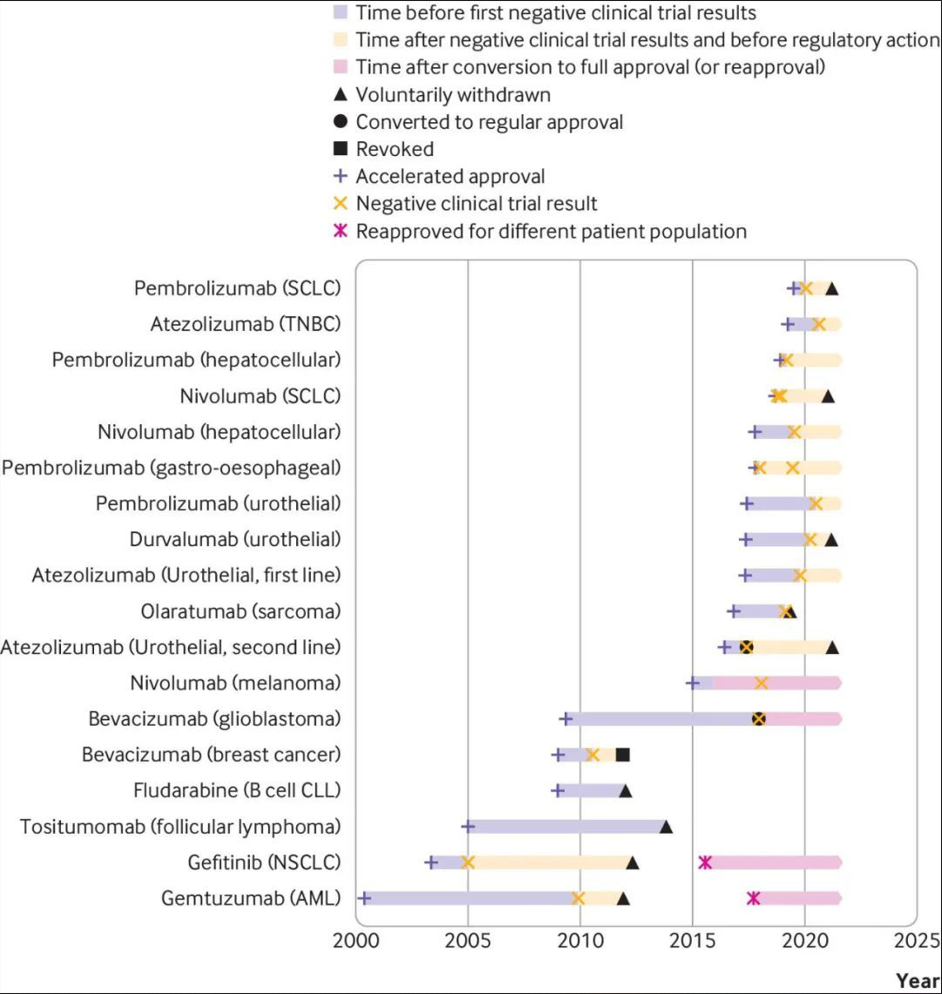
FDA没能”将未能在验证性试验中验证其临床获益”的药物及时撤销使这项新药审批政策饱受诟病。2020年底,FDA对“加速批准”路径展开了全行业大审查,对那些曾通过加速批准通道上市,但未能在验证性试验中验证其临床获益的在市销售适应症进行清算,截至到2022年11月29日,已经有8个适应症遭到了撤市。最近FDA再次收紧“加速批准”审批政策,也明显看到撤销的提速。先前葛兰素史的其上市BCMA-ADC药物Blenrep的一项验证性III期临床DREAMM-3试验宣告失败,而在两周后就被迅速宣布了撤市。
参考出处:
1992-2020年间:获FDA“加速批准验证临床未通过”抗癌药撤销、撤回、转正等监管处理情况全分析
https://endpts.com/fda-pulls-oncopeptides-pepaxto-indication-opening-the-door-for-dangling-accelerated-approval-enforcement/

 产业资讯
产业资讯
 药视声
药视声  2025-07-01
2025-07-01
 34
34

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-07-01
2025-07-01
 32
32

 产业资讯
产业资讯
 美股滚雪球
美股滚雪球  2025-07-01
2025-07-01
 35
35