 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2022-12-13
2022-12-13
 2194
2194
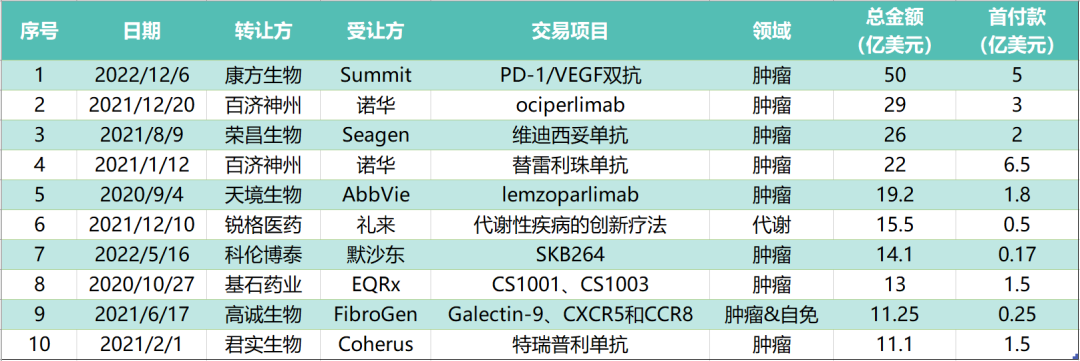
本文整理了截止目前中国创新药 license out 交易Top10,与君共飨。
NO.1 PD-1/VEGF双抗
2022年12月6日,康方生物宣布将授予Summit Therapeutics于美国、加拿大、欧洲和日本的开发和商业化依沃西(PD-1/VEGF双特异性抗体)的独家许可权;康方生物保留依沃西除以上地区之外的开发和商业化权利,包括中国。
康方生物将获得5亿美元的首付款。包括开发、注册及商业化里程碑款项付款,该交易总金额有望高达50亿美元。同时康方生物还将收到销售净额的低双位数比例的提成作为依沃西的特许权使用费。
依沃西(中国和澳大利亚的研发代号:AK112)是康方生物独立开发的一种潜在的全球首创双特异性抗体,可同时阻断PD-1和VEGF通路,可“一药双靶”同时发挥免疫效应和抗血管生成效应。至今尚无基于PD-1的双特异性抗体被FDA或EMA批准。依沃西是目前全球临床开发进度最快的PD-1/VEGF双特异性抗体。依沃西已经获得中国国家药品监督管理局的3项突破性疗法认定,包括依沃西单药对比帕博利珠单抗单药一线治疗PD-L1表达阳性的NSCLC的III期临床研究。
NO.2 Ociperlimab
2021年12月20日,百济神州宣布与诺华制药集团达成选择权、合作和授权许可方面的协议,双方将在北美、欧洲和日本共同开发、生产和商业化百济神州在研TIGIT抑制剂Ociperlimab。百济神州将从诺华获得 3 亿美元的现金预付款,并在诺华于 2023 年年中前或年中到2023 年年底期间行使独家的、基于时间的选择权时额外获得6亿或7 亿美元付款,取决于获取所需的反垄断批准。
此外,诺华行使选择权后,百济神州有权获得至多7.45 亿美元的药政获批里程碑付款、 11.5 亿美元的销售里程碑付款,以及基于Ociperlimab在许可地区的销售获取提成作为特许权使用费。
Ociperlimab是一款在研强效TIGIT抑制剂,具备完整的Fc段功能。Fc段对于TIGIT抗体的抗肿瘤活动能力至关重要。TIGIT 通路被认为可与 PD-1 协作,最大程度抑制效应肿瘤浸润免疫细胞,并增强对抗 PD-1 疗法的抵抗力。TIGIT 是有望能够为更多患者带来提升抗 PD-1 疗法获益的一个靶点。
NO.3 维迪西妥单抗
2021年8月8日,荣昌生物与西雅图基因(SeagenInc.)达成一项全球独家许可协议,以开发和商业化其ADC新药维迪西妥单抗。荣昌生物保留在亚洲区(除日本、新加坡外)临床开发和商业化的权利,西雅图基因获得维迪西妥单抗在荣昌生物区域以外的全球开发和商业化权益。
维迪西妥单抗是由荣昌生物研发的我国首个原创抗体偶联(ADC)药物,以肿瘤表面的HER2蛋白为靶点,能精准识别和杀伤肿瘤细胞,在治疗胃癌、尿路上皮癌、乳腺癌等肿瘤的临床试验中均取得了全球领先的临床数据,是我国首个获得美国FDA、国家药品监督管理局突破性疗法双重认定的ADC药物。
NO.4 替雷利珠单抗
2021年1月12日,百济神州宣布与诺华达成一项合作与授权协议,在多个国家(包括美国、加拿大和日本等)共同开发、生产和商业化PD-1 抗体百泽安®(替雷利珠单抗)。根据协议,百济神州将获得 6.5 亿美元的预付款,并有资格在达到注册里程碑事件后获得至多 13亿美元的付款、在达到销售里程碑事件后获得 2.5 亿美元的付款,另有资格获得百泽安®在授权地区未来销售的特许使用费。
百泽安®是一款人源化 IgG4 抗 PD-1 单克隆抗体,也是国内第一款 Fc段优化的 PD-1 单抗,可以最大限度地减少其与巨噬细胞中的 FcγR 受体结合,更好地发挥抗肿瘤作用。在中国,百泽安®由百济神州实现商业化,另有多项临床研究正在开展。
NO.5 lemzoparlimab
天境生物宣布与艾伯维达成了一项许可协议,将其CD47单抗lemzoparlimab(TJC4)在大中华区以外地区的开发及商业化许可给后者,保留该项目在中国大陆、中国香港和中国澳门的开发和商业化权利。
CD47抗体可针对多种适应症,包括非霍奇金淋巴瘤(NHL)、急性髓性白血病(AML)等血液系统恶性肿瘤,以及结肠直肠癌、卵巢癌、乳腺癌、膀胱癌和头颈癌等实体瘤,具有广谱性特点,在全球肿瘤免疫领域里面被认为一个可能是最有潜力的少数的几个靶点之一,未来潜在市场空间较为广阔。CD47作为全球肿瘤免疫领域最有潜力的靶点,但挑战在于CD47抗体会在临床上面引起严重的贫血,该原研导致了多个CD47项目的结束。但天境生物创始人臧敬五表示该CD47抗体具有差异化优势,在保留强有力的与肿瘤细胞结合能力的同时可最大限度地减少与正常红细胞结合,且不产生血凝作用。
NO.6 代谢性疾病的创新疗法
锐格医药(Regor Therapeutics Group)与礼来签署了一项为期多年的研究合作和许可协议,以发现、开发和商业化代谢紊乱的新疗法。
根据协议条款,礼来将拥有选择Regor知识产权的许可,并可选择延长许可。礼来将负责全球的临床开发、生产和商业化,但Regor将保留大中华区的权利和责任。该协议将使每家公司有机会充分利用双方在全球现有的化合物和技术,以最大限度地提高患者的治疗选择。
NO.7 SKB264
2022年5月16日,科伦药业发布公告宣布其控股子公司科伦博泰于与默沙东达成一项许可协议。科伦博泰将其具有自主知识产权的生物大分子肿瘤项目 A 有偿独家许可给默沙东进行中国以外(中国包括中国大陆,香港、澳门和台湾)区域范围内的商业化开发。MSD 将根据商业化开发阶段向科伦博泰支付首付款、各类里程碑付款及相应净销售额提成。科伦博泰于许可协议生效时收到 1700 万美元一次性、不可退还的付款,协议修正案签署后收到 3000 万美元一次性、不可退还的付款,里程碑付款累计不超过 13.63 亿美元,并按双方约定的净销售额比例提成。
后据外界推测,本次授权的药物为靶向TROP2的ADC产品,代号SKB264。TROP2作为一个新兴的泛瘤种靶点,在三阴乳腺癌、非小细胞肺癌、卵巢癌等多个瘤种中均有高表达。且SKB-264已被CDE纳入“突破性治疗品种”名单。
NO.8 CS1001、CS1003
2020年10月27日,基石药业宣布与EQRx达成战略合作。基石药业将独家授权EQRx在大中华区以外地区开发和商业化舒格利单抗(CS1001,抗PD-L1单抗)及CS1003(抗PD-1单抗)。
作为一种全人源全长的抗PD-L1单克隆抗体,舒格利单抗是一种最接近人体自身天然G型免疫球蛋白4(IgG4)的单抗药物。它可降低在患者体内产生免疫原性及相关毒性的风险,与同类药物相比具有潜在的独特优势。舒格利单抗已获得 FDA 授予的成人复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)的突破性疗法认定以及治疗T细胞淋巴瘤的孤儿药资格认定。CS1003也获得了 FDA 授予的治疗肝细胞癌的孤儿药资格。
NO.9 Galectin-9、CXCR5和CCR8
2021年6月17日,FibroGen, Inc. 与 HiFiBiO Therapeutics(高诚生物),共同宣布达成了一项涵盖三个在研项目的合作。FibroGen 获得高诚生物 Galectin-9 项目独家授权许可,及CXCR5和CCR8项目独家开发、生产和商业化授权选择权。涉及肿瘤免疫和自身免疫领域。
NO.10 特瑞普利单抗
2021年2月1日,君实生物宣布与Coherus BioSciences已就特瑞普利单抗注射液(拓益®,产品代号:JS001)在美国和加拿大的开发和商业化达成合作。
君实生物已在中国实现了特瑞普利单抗的商业化,并被纳入国家医保药品目录。预计未来特瑞普利单抗将有更多重大研究的数据发布,在多种实体瘤中评估不同治疗方案的有效性。且特瑞普利单抗治疗鼻咽癌已获得 FDA 授予的突破性疗法认定,此外,FDA还授予特瑞普利单抗1项快速通道资格认定(黏膜黑色素瘤),以及3项孤儿药资格认定(黏膜黑色素瘤、鼻咽癌、软组织肉瘤)。
不难看出,这些TOP级的大额交易,基本都集中于肿瘤领域,这个群雄逐鹿但依然存在巨大临床需求的细分市场。从疯狂“内卷”的PD-1,到潜力靶点TIGIT和TROP2,从ADC到双抗,随着基础研究的进步逐渐揭开生理机制的面纱,资本的流入不断助力研究的开展,我们看到,一个个不断刷新的出海记录,不仅是国内创新药实力的展现,更是是肿瘤患者不断提高的生存率,是通向癌症被治愈的希望之路。
信息来源:
1.各公司官网及公告
2.新浪财经

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-05-12
2025-05-12
 37
37

 产业资讯
产业资讯
 医药时间
医药时间  2025-05-12
2025-05-12
 39
39

 产业资讯
产业资讯
 研发客
研发客  2025-05-12
2025-05-12
 38
38