 产业资讯
产业资讯
 药明康德
药明康德  2023-02-07
2023-02-07
 2434
2434
本期看点
1. 治疗囊性纤维化的吸入式mRNA疗法ARCT-032获准在新西兰开展首个1期人体试验。
2. 潜在“best-in-class”Tau蛋白抗体PRX005脑渗透性良好,1期多剂量递增研究结果有望年底公布。
3. 用于治疗纤维狭窄性克罗恩病的ALK5小分子抑制剂AGMB-129的初步研究显示其限制在胃肠道中起效的作用机制可在人类中有效运作。
4. 用以治疗焦虑症的创新氘代N,N-二甲基色胺(DMT)分子CYB004在早期研究中展现长效潜力,有望克服传统DMT因不稳定导致生物利用度低的局限性。
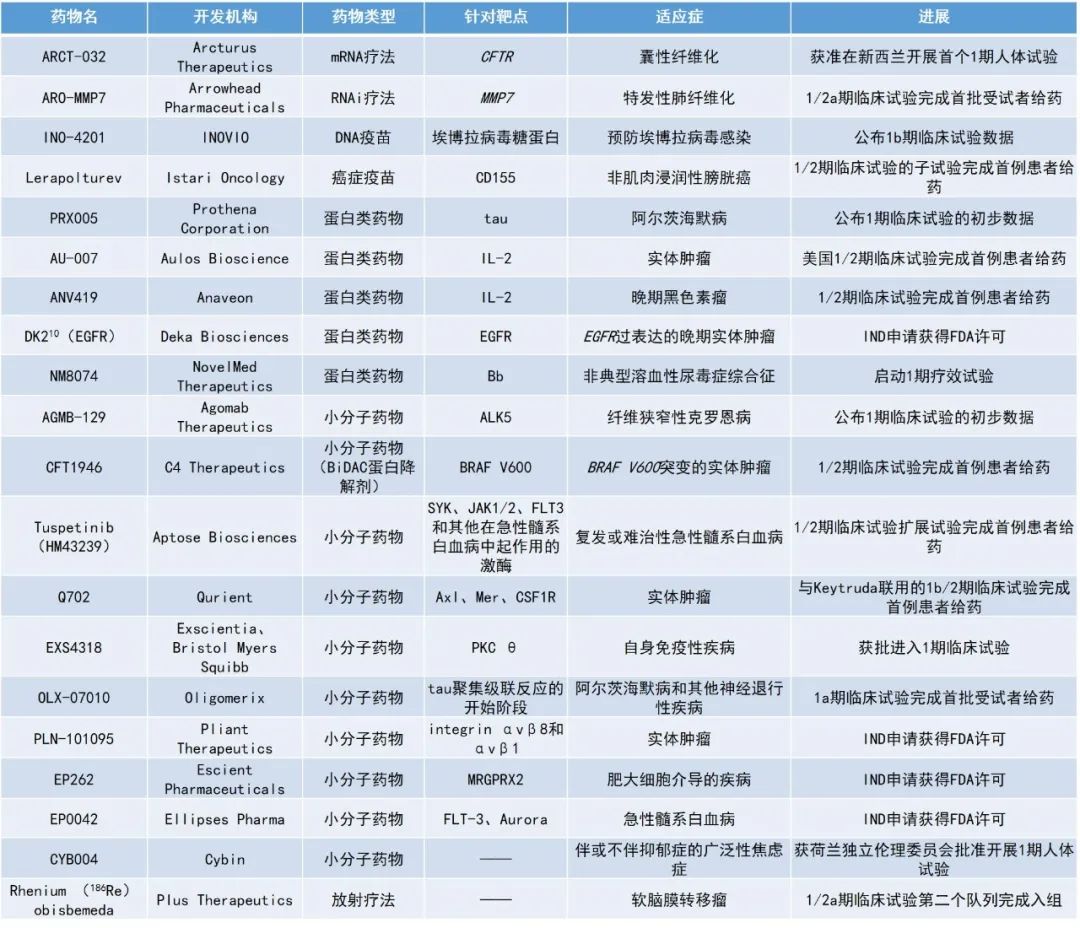
药明康德内容团队整理
ARCT-032:获准在新西兰开展首个1期人体试验
ARCT-032是Arcturus Therapeutics公司开发的在研吸入式mRNA疗法,用于治疗囊性纤维化(CF)。该候选mRNA疗法的临床试验申请(CTA)在近期获得批准,将在新西兰开展首个1期人体试验。CF是一种由CFTR基因的某些突变导致CFTR蛋白功能缺陷和/或缺失引起的的罕见遗传疾病。
ARCT-032能够利用Arcturus的LUNAR脂质介导雾化平台递送CFTR mRNA抵达肺部。在CF患者的肺部表达CFTR mRNA的功能拷贝有可能会恢复CFTR蛋白活性并减轻导致进行性肺部疾病的下游影响。在临床前研究中,ARCT-032已在啮齿类动物、雪貂和灵长类动物中获得了数据支持,并被证实在人类支气管上皮细胞中可恢复CFTR蛋白的表达和功能。
PRX005:公布1期临床试验的初步数据
Prothena Corporation公司公布了其在研Tau蛋白抗体疗法PRX005在健康受试者中的1期单剂量递增研究结果。Tau蛋白是一种与微管结合的蛋白,在阿尔茨海默病(AD)患者的大脑中,Tau蛋白聚集和超磷酸化产生的病理性神经原纤维缠结是患者大脑的标志性特征之一,Tau蛋白也是AD药物开发的重要靶点。以往的临床前研究显示,致病Tau蛋白能够在神经细胞之间传播。PRX005是一款用于治疗AD潜在“best-in-class”的Tau蛋白抗体,它能与Tau蛋白的微管结合域(MTBR)相结合,旨在阻断致病Tau蛋白被细胞摄入,从而降低下游细胞毒性。
此次公布的数据显示,健康受试者血浆中的PRX005浓度与剂量成正比,并具有强大的中枢神经系统(CNS)渗透性。三个剂量队列中,PRX005的安全性和耐受性良好,达到了试验的主要终点。在健康受试者和AD患者中进行的1期多剂量递增试验正在进行中,有望在2023年年底公布顶线结果。
AGMB-129:公布1期临床试验的初步数据
Agomab Therapeutics公司公布了其开发的口服ALK5小分子抑制剂AGMB-129在健康受试者中1期试验的积极结果。AGMB-129旨在专门抑制胃肠道中的ALK5,用于治疗纤维狭窄性克罗恩病(FSCD)。多达50%的克罗恩病患者中会发生纤维狭窄这种并发症,它是肠切除手术的主要原因。
AGMB-129能够在肝脏中经由首过代谢快速被消除,可防止临床相关的全身暴露,与同类抑制剂相比,安全性有所提高。此次公布的结果显示,AGMB-129在所有给药方案中的耐受性均良好,回肠局部暴露率高,血浆PK分析显示没有临床相关的全身暴露,证明其胃肠道限制机制可在人类中有效运作。1期研究中的良好安全性支持在FSCD患者中开展计划的全球2a期研究,以进一步对AGMB-129进行评估。
CYB004:获荷兰独立伦理委员会批准开展1期人体试验
CYB004是Cybin公司开发的氘代N,N-二甲基色胺(DMT)分子,计划用于治疗伴有或不伴有抑郁症的广泛性焦虑症。在常见形式下,DMT是一种不稳定的分子,在体内会被迅速代谢,这将大大降低其生物利用度,CYB004则有望克服DMT的这种局限性。临床前研究表明,与DMT相比,CYB004通过静脉注射(IV)和吸入途径给药时,其生物利用度和药代动力学特征有所改善,并且通过IV途径的CYB004作用持续时间更长。也就是说,CYB004具有延长治疗窗口并提供更好的剂量优化潜力。此外,CYB004有望通过吸入、皮下或肌肉内给药途径,为患者提供更方便的给药方法。CYB004的首个1期试验正在荷兰人类药物研究中心进行。Cybin公司在新闻稿中指出,该试验是迄今为止规模最大的1期DMT试验。
INO-4201:公布1b期临床试验数据
INOVIO公司公布了其候选疫苗INO-4201的积极1b期试验结果。INO-4201是一种针对埃博拉病毒(ZEBOV)糖蛋白(GP)的DNA疫苗,被作为先前接受过单次注射Ervebo的健康成年受试者的加强剂。该候选疫苗在试验中的耐受性良好,并提高了100%(36/36)受试者的体液反应。
DK210(EGFR):IND申请获得FDA许可
DK210(EGFR)是Deka Biosciences公司利用其Deka分子平台开发的新型细胞因子疗法。该平台中的每个Diakine分子都包含两个细胞因子,它们结合在靶向特定组织蛋白的骨架系统上,这种技术使细胞因子能够更准确地在特定组织中积聚。两种细胞因子的组合能在增加效力的同时降低毒性。此外,靶向系统还提高了药物的疗效、安全性和可制造性。DK210(EGFR)包含了野生型的IL-2和具高亲和力的IL-10这两种细胞因子,将在EGFR过表达的晚期实体肿瘤患者中开展1期临床试验。
EXS4318:获批进入1期临床试验
EXS4318是由人工智能(AI)医药技术公司Exscientia利用AI设计的潜在“first-in-class”强效选择性PKC θ抑制剂,百时美施贵宝(BMS)于2021年8月获得了该候选化合物的授权许可。PKC θ在控制T细胞功能方面起着关键作用,是几种广泛流行的自身免疫性疾病的关键驱动因素。PKC θ抑制剂在炎症和免疫性疾病中具有潜力。近日,EXS4318获批在美国进入1期临床试验,正在被开发用于免疫学和炎症相关适应症。
PLN-101095:IND申请获得FDA许可
PLN-101095是Pliant Therapeutics公司开发的口服靶向整合素αvβ8和αvβ1的双重选择性小分子抑制剂,用于治疗对免疫检查点抑制剂耐药的实体肿瘤。TGF-β信号传导的增加被认为是肿瘤细胞对免疫检查点抑制剂耐药的潜在原因。PLN-101095靶向肿瘤微环境中表达的整合素αvβ8和αvβ1,能够调节TGF-β的活性,旨在恢复肿瘤对PD-1/PD-L1抑制剂的敏感性。
EP262:IND申请获得FDA许可
EP262是Escient Pharmaceuticals公司开发的一款潜在“first-in-class”的MRGPRX2受体小分子拮抗剂。该公司专注于一类称为Mas相关G蛋白偶联受体(MRGPRs)的创新细胞表面受体。MRGPRX2是一种在屏障组织(例如皮肤、气道、胃肠道)中发现的,并在肥大细胞上表达的受体。该受体激活会导致肥大细胞脱颗粒并释放组胺、类胰蛋白酶、糜蛋白酶、趋化因子和细胞因子,这会导致荨麻疹、血管性水肿、慢性瘙痒和疼痛等疾病。
通过阻断MRGPRX2的激活,EP262有潜力治疗范围广泛的肥大细胞介导的疾病。该公司将首先把开发重点放在慢性荨麻疹和特应性皮炎(湿疹)上,计划在2023年上半年在健康受试者中开展1期试验,并在下半年启动多项概念验证研究,以评估其在慢性诱发性荨麻疹、慢性自发性荨麻疹和特应性皮炎患者中的疗效。
EP0042:IND申请获得FDA许可
EP0042是Ellipses Pharma公司开发的一种FLT3和Aurora激酶双重抑制剂,旨在成为已对FLT3抑制剂产生耐药性的急性髓系白血病(AML)患者的新疗法。大约三分之一的AML患者携带FLT3突变,该突变与更高的复发风险和不良临床结局相关。在2022年的美国血液学会(ASH)年会上,Ellipses公司已公布了其首个1/2期临床试验的初步数据。该数据表明EP0042具有可接受的安全性和耐受性,并且有证据显示,许多已接受过多线治疗的患者的疾病控制(DC)时间得到了延长。此次IND申请获得批准将使Ellipses能够扩大该临床试验。

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-05-12
2025-05-12
 120
120

 产业资讯
产业资讯
 医药时间
医药时间  2025-05-12
2025-05-12
 122
122

 产业资讯
产业资讯
 研发客
研发客  2025-05-12
2025-05-12
 121
121