 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2023-02-17
2023-02-17
 2743
2743
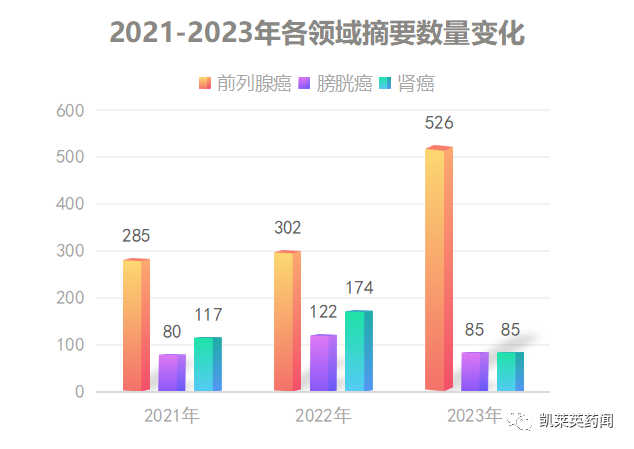
2023年泌尿领域的首场重磅国际会议——ASCO GU,将于美国当地时间2月16-19日在美国旧金山召开。本次大会共接收摘要767篇,其中前列腺癌相关摘要526篇,膀胱癌85篇,肾癌85篇。
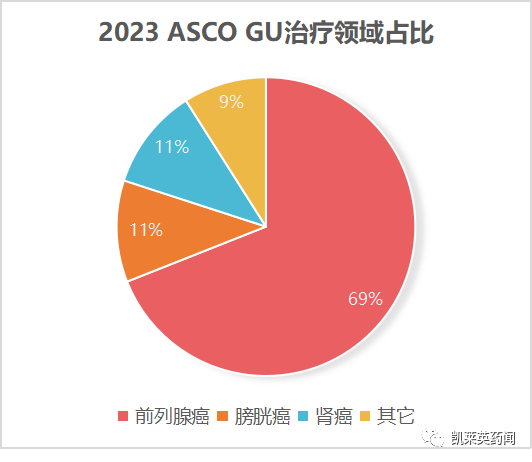
前列腺癌是男性第二大最常见的癌症,也是全球男性癌症死亡的第五大原因,2020年发病率为140万,死亡人数为37.5万。作为大会的热点的聚焦领域,前列腺癌的摘要从数量上看,远超膀胱癌、肾癌领域,且逐年增多。
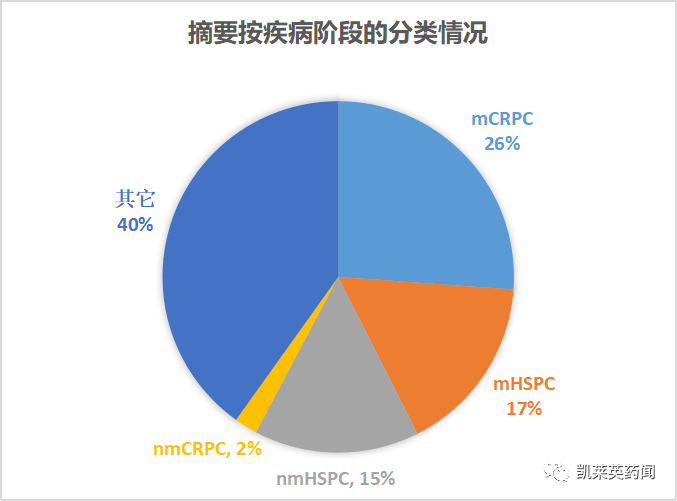
按照疾病阶段来看:转移性去势抵抗性前列腺癌(mCRPC)、转移性激素敏感性前列腺癌(mHSPC)、非转移性激素敏感性前列腺癌(nmHSPC)为热点方向,数量分别是86、54、50篇;非转移性去势抵抗性前列腺癌(nmCRPC)的摘要相对较少,数量为7篇。
从治疗选择看:2/3的摘要集中在新型内分泌及放疗疗法,其次是免疫治疗、PARP抑制剂、创新疗法。
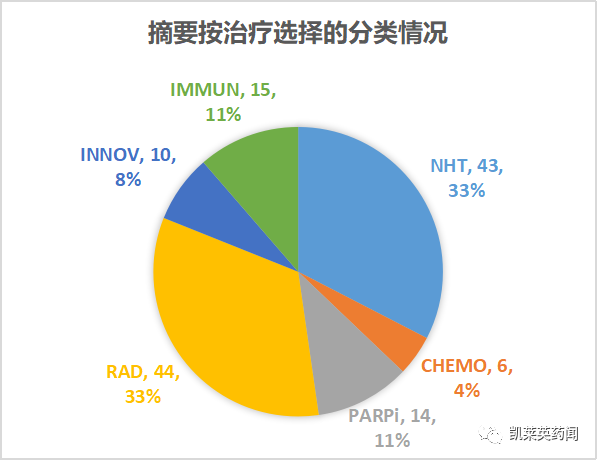
NHT:新型内分泌治疗;CHEMO: 化疗;PARPi:PARP抑制剂;RAD:放射治疗(含核素治疗);IMMUN:免疫治疗;INNOV:创新疗法;总结下来:针对mHSPC阶段,大会公布了ARASENS、PEACE-1等研究的最新数据,证明了早期强化对患者的获益,开启了mHSPC三联疗法的新时代;对于mCRPC,大会纳入了核素以及多项新型内分泌治疗(NHA)联合PARPi的研究进展;对于nmCRPC,,主要围绕真实世界研究中药物治疗选择与偏好等方面展开。接下来,我们通过对2种PARP抑制剂、1种GoCAR-T细胞疗法、1种靶向PSMA抗体偶联药物(ADC)的临床分析,窥见整个领域的最近进展。
Part.1
阿斯利康&默沙东:Lynparza
Lynparza(奥拉帕利)是全球首款获批上市的 PARP 抑制剂,也是首个在携带HRR缺陷(如BRCA1和/或BRCA2突变)或由其他药物(如NHAs)诱导缺陷的细胞/肿瘤中阻断DNA损伤反应(DDR)的靶向治疗。随着2004年用于 BRCA 突变的晚期卵巢癌患者适应症获批后,适应症不断拓展,在 2017年获批卵巢癌维持治疗;2018 年进入乳腺癌领域,获批用于BRCA 突变转移性乳腺癌;2020 年 5 月,获批用于HRD+、BRCA 突变晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌,以及 HRR 基因突变晚期/转移性去势抵抗性前列腺癌。2017年7月,阿斯利康与默沙东达成战略合作协议,联合开发和商业化Lynparza。
根据在2023 ASCO GU公布的数据,在一项随机、双盲、多中心 III 期PROpel试验中,比较Lynparza与安慰剂分别联合阿比特龙以及泼尼松或泼尼松龙治疗的有效性、安全性和耐受性。结果显示:在mCRPC中的最终预先指定的总生存期(OS)分析中,Lynparza联合阿比特龙和泼尼松龙或泼尼松龙的中位OS为42.1个月,而阿比特龙加安慰剂为34.7个月。
整个试验人群的结果表明,Lynparza和阿比特龙联合使用,进一步验证了DNA损伤修复通路与雄激素受体(AR)信号通路之间可相互影响,同时抑制这两条通路具有潜在的“协同机制”。进一步确证“协同AR通路致死”机制,有望再次改写mCRPC治疗格局。
Part.2
强生:Niraparib
Niraparib(尼拉帕尼)是口服、高选择性PARP 抑制剂,该药物最早于2017年3月获FDA批准用于上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的维持治疗。2016 年 4 月,杨森与 TESARO(2019 年被GSK收购)签订了全球(日本除外)合作和许可协议,获得尼拉帕尼在前列腺癌中的开发权。2022 年 4 月,杨森根据 MAGNITUDE 研究数据向EMA提交了一份上市许可申请,用于niraparib与醋酸阿比龙、强的松或prednisolone联用。
根据在2023 ASCO GU公布的数据,在3期,随机,双盲,安慰剂对照,多中心MAGNITUDE研究中,评估尼拉帕尼联合阿比特龙加泼尼松龙 (AAP)治疗mCRPC患者的安全性和有效性。第二次中期分析(IA2)中,(1)尼拉帕尼和AAP的治疗组合与安慰剂相比,在中位随访26.8个月时,显示出症状进展(TSP)的时间在统计学上显着延长,且在HRR阳性人群中,细胞毒性化疗(TCC)的开始时间获得持续改善,HRR阳性人群BRCA亚组的TSP有显著改善;(2)放射影像学无进展生存期(rPFS)主要终点与初始结果一致,显示HRR阳性人群和BRCA亚组均有统计学意义的益处;(3)在BRCA亚组中观察到OS改善的趋势。(4)没有发现新的安全信号。上述数据,将进一步支持验证尼拉帕尼与AAP联合用于mCRPC和BRCA突变患者的潜在用途。
Part.3
Bellicum:BPX-601
BPX-601是Bellicum的第一个GoCAR-T候选产品,它结合了Bellicum的诱导共激活域iMC。iMC(诱导型MyD88 / CD40)旨在为T细胞增殖和持久性提供强大的促进作用,产生免疫调节细胞因子,并使CAR-T能够覆盖关键的免疫抑制机制,包括PD-1和TGF-β。目前,BPX-601正开发用于表达前列腺干细胞抗原(PSCA)的mCRPC的治疗方法。PSCA是由人体自然产生的一种蛋白质编码基因,最初被鉴定为肿瘤抗原的细胞表面上发现的一种蛋白质,随后的研究显示出PSCA在包括胰腺癌在内的癌症中表达上调,60%到80%的胰腺癌都表达PSCA。
根据在2023 ASCO GU公布的数据,1期多中心试验的早期结果显示,BPX-601与rimiducid联合治疗重度预处理的患者具有初步疗效。其中:(1)8例患者中有4例(50%)达到PSA50缓解,其中3例达到PSA90缓解。(2)在6例软组织(内脏和/或淋巴结)疾病患者中,2例对RECIST v1.1产生部分反应,其中1例得到证实。(3)在两名仅患有骨疾病的患者中,一名患者在骨扫描中观察到骨病变增强程度降低,达到PSA90反应。(4)观察到患者的BPX-601细胞持续扩增,外周血中检测到BPX-601细胞持续存在超过200天。(5)观察到可诱导的iMC 激活的证据,血清促炎T细胞因子(包括IFNγ、TNFα、IL-6和IP-10)水平在给药后上升,随后在后续剂量之前下降。(6)在PSCA阳性肿瘤中观察到BPX-601细胞浸润。
Part.4
Ambrx:ARX517
ARX517是Ambrx研发的一款靶向PSMA的ADC,由一个全人源的抗PSMA单抗和两个微管蛋白抑制剂AS269构成。AS269为Ambrx专有的、强效的微管蛋白抑制剂,可与抗体里的合成氨基酸形成高度稳定的共价键。在临床前试验中,ARX517在恩扎卢胺敏感性和耐药性前列腺癌模型中展现出活性。
根据在2023 ASCO GU公布的数据,在APEX-01研究的1期剂量递增部分,ARX517的递增剂量水平每3周作为单一药物给药。主要终点是安全性、耐受性和药代动力学。关键的次要终点是前列腺特异性抗原(PSA)从基线和/或肿瘤缩小的客观下降。结果显示:(1)接受 ARX517 治疗的 3 名转移性前列腺癌患者中,有 3 名患者的PSA比基线降低 > 50%;(2)3 名患者中有 2 名的 PSA 水平降低了 90% 以上;(3)未观察到与药物相关的严重不良事件(SAE)或剂量限制毒性(DLT)。这些数据为单药ARX517作为晚期前列腺癌ADC治疗的概念验证提供了早期证据。
参考资料:
1、公司官网
2、医学界肿瘤频道,原文链接:https://mp.weixin.qq.com/s/0rx939kaZ2DiLdhmt8FbXQ

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-07
2025-05-07
 30
30

 产业资讯
产业资讯
 研发客
研发客  2025-05-07
2025-05-07
 30
30

 产业资讯
产业资讯
 药渡
药渡  2025-05-07
2025-05-07
 31
31