 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2023-02-20
2023-02-20
 3573
3573
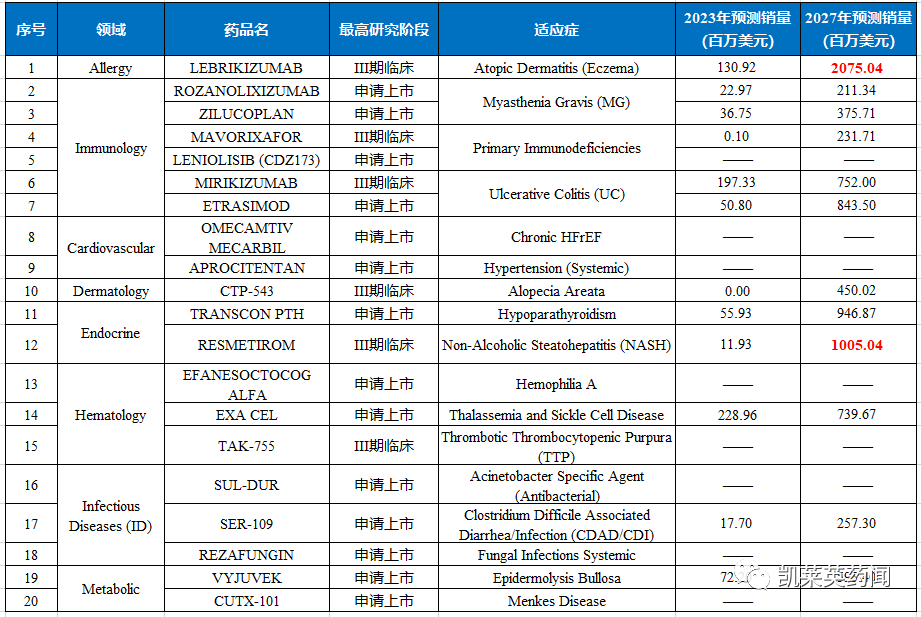
一直以来,创新药的开发和商业化都是一项至关重要的任务,关系到患者的生命和生活质量。未来 5 年,市场上合计价值 900 亿美元的十大畅销药品和生物制品将失去专利独占权,并面临仿制药和生物类似药的竞争。鉴于此,2023年哪些新药有望上市,甚至成为占据市场份额的风云药物?我们将推出两期内容进行分析。
在本篇文章中,我们对Allergy(过敏反应)、Immunology(自身免疫)、Cardiovascular(心血管)、Dermatology(皮肤)、Endocrine(内分泌)、Hematology(血液学)、Infectious Diseases(传染病)、Metabolic(代谢)领域的潜力上市药物进行汇总。预测2027年,销量有望突破10亿美元的重磅品种依次是:用于治疗特应性皮炎的抗IL-13单抗Lebrikizumab和用于治疗NASH的甲状腺激素受体β激动剂Resmetirom。
Part.1
过敏反应领域
1、礼来/ Almirall:Lebrikizumab
作用机制:抗IL-13单抗
适应症:特应性皮炎(AD)
Lebrikizumab是一款靶向白介素13(IL-13)的生物制剂,也是一种新型的、在研的单克隆抗体,旨在以高亲和力结合 IL-13,以特异性阻止 IL-13Rα1/IL-4Rα 异二聚体复合物的形成和随后的信号传导,从而抑制 IL-13 在靶向治疗中的生物学效应。IL-13 是特应性皮炎的中心致病介质,促进导致皮肤屏障功能障碍、瘙痒、皮肤增厚和感染的 2 型炎症。2020年1月,礼来斥资11亿美元收购Dermira,获得lebrikizumab在美国、欧洲以外其他国家的独家开发和商业化权利。此外,Almirall已获授权lebrikizumab在欧洲开发和商业化权利,用于治疗包括AD在内的皮肤病适应症。ADvocate 1和ADvocate 2是为期 52 周的随机、双盲、安慰剂对照、平行组、全球性 3 期研究,旨在评估 lebrikizumab作为成人和青少年患者(12 至 18 岁以下且体重至少 40 公斤)中重度特应性皮炎的单一疗法的效果。治疗16周取得临床应答(EASI-75)的患者,接受lebrikizumab每2周或每4周一次方案治疗一年后,约有80%的患者仍然维持皮损清除。此外,在一年期间,患者继续保持瘙痒症状缓解。总的来看,2项研究均达到了主要终点和全部次要终点,包括皮损清除、瘙痒改善、生活质量改善。采用EASI评估,有一半以上的患者湿疹面积和严重程度指数(EASI)评分相对基线改善≥75%(EASI-75)。礼来和Almirall计划到2022年底分别向美国和欧洲提交申请。
Part.2
自身免疫领域
1、UCB:Rozanolixizumab
作用机制:抗FcRn单抗
适应症:全身性重症肌无力
Rozanolixizumab是一款靶向新生儿Fc受体(FcRn)的人源化单克隆抗体,旨在减少致病性免疫球蛋白G(IgG)抗体,阻断IgG再循环过程。FcRn受体的作用是防止IgG的降解,因此通过防止IgG与FcRn的结合,能够导致介导自身免疫性疾病的IgG抗体更快耗竭,从而减轻疾病症状。目前,rozanolixizumab正被开发通过驱动致病性IgG自身抗体的清除,来治疗多种由致病性IgG自身抗体驱动的自身免疫性疾病,包括全身型重症肌无力(gMG)、原发性免疫性血小板减少症(ITP)、抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体(MOG-IgG)相关疾病(MOGAD)、自身免疫性脑炎(AIE)。2023年1月,该药物的生物制品许可申请(BLA)已获FDA受理,并授予优先审评资格,用于治疗抗乙酰胆碱受体(AChR)或抗肌肉特异性酪氨酸激酶(MuSK)抗体阳性成人gMG。该BLA是基于关键的III期MycarinG研究数据,结果显示从基线到第43天,rozanolixizumab显著降低MG-ADL(重症肌无力日常生活活动)评分;与安慰剂相比,rozanolixizumab的的LS平均差异(95% CI)分别为-2.59分和-2.62分。此外,与安慰剂相比,rozanollizumab组患者MG-ADL改善≥2分患者比例更高(p<0.001),定量重症肌无力量表(QMG)评分改善≥3分以及重症肌无力综合评分改善≥3分的患者比例也更高。
2、UCB:Zilucoplan
作用机制:C5抑制剂
适应症:全身性重症肌无力
Zilucoplan是一款经皮下给药的新型大环肽类C5补体抑制剂,可以与末端补体激活途径的组分C5特异性结合,防止C5被C5转化酶裂解为补体成分C5a和C5b,进而阻止膜攻击复合物(MAC)的下游组装和活性。此外,该药与对应于C5b的C5结构域结合,还可阻断C5b与补体成分C6的结合。通过抑制末端补体途径激活和MAC下游组装的双重作用机制,zilucoplan可防止它们破坏离子通道传导和神经肌肉信号传递。目前,该药正被开发用于治疗gMG以及其他基于补体介导的罕见疾病。2022年2月,zilucoplan在一项针对全身性重症肌无力成人患者开展的3期临床试验中,显示与安慰剂相比,接受zilucoplan治疗的全身性重症肌无力成人患者症状显著改善,达到了主要终点和所有关键次要终点。
3、X4/和誉生物:mavorixafor
作用机制:CXCR4 拮抗剂
适应症:WHIM 综合征
mavorixafor 是一种新型CXCR4 拮抗剂,正在开发为每日一次的口服疗法,它是是第一个也是唯一一个证明可以持久改善严重慢性中性粒细胞减少症和淋巴细胞减少症的口服研究疗法,于 2018 年和 2019 年陆续被美国FDA 授予孤儿药资格和突破性疗法资格。4WHIM 3 期临床试验是一项全球性、随机、双盲、安慰剂对照、多中心研究,旨在评估口服、每日一次的 mavorixafor 对经基因证实的 WHIM 综合征患者的疗效和安全性,研究显示:mavorixafor达到了其主要终点和关键的次要终点;药物总体耐受性良好,没有报告与治疗相关的严重不良事件,也没有因安全事件而停药。2019 年 7 月,和誉生物于 与 X4 Pharmaceuticals 达成协议,获得 mavorixafor 在大中华地区的开发与商业化达成独家合作协议。
4、Pharming Group :Leniolisib
作用机制:PI3Kδ抑制剂
适应症:PI3Kδ过度活化综合征
LENIOLISIB (CDZ173)是一种口服选择性磷酸肌醇-3激酶δ(PI3Kδ)抑制剂,PI3Kδ抑制剂能够选择性抑制I类PI3Kγ亚型的化合物,PI3Kγ在白细胞中表达,在趋化因子依赖性白细胞的趋化性和肥大细胞的激活中起关键作用。这种类型的药物在治疗各种疾病,如炎症、呼吸和代谢疾病以及癌症方面非常有用。在一项针对leniolisib 的II/III期拓展研究显示,中位持续时间为102周时,37%接受免疫球蛋白替代疗法(IRT)的患者,在服用leniolisib期间能够减少IRT的使用,有6例患者摆脱对IRT的依赖。在试验前有淋巴瘤病史的3例患者中无人出现复发或新发淋巴瘤。目前,leniolisib正接受FDA优先审查。
5、礼来:MIRIKIZUMAB
作用机制:抗IL-23p19抗体
适应症:溃疡性结肠炎
Mirikizumab是一种人源化IgG4单克隆抗体,可与IL-23的p19亚基结合,阻断IL-23介导的炎症反应。目前,mirikizumab正在开发用于治疗免疫性疾病,包括银屑病、溃疡性结肠炎(UC)和克罗恩病。在UC患者中开展的III期LUCENT-1临床试验显示,与安慰剂相比,mirikizumab在12周时达到临床缓解的主要终点(p<0.0001);此外,mirikizumab还达到所有关键性次要终点,包括降低排便急迫感,临床应答、内镜缓解、以及内镜组织学炎症改善等。mirikizumab 最早在接受治疗4周时就开始生效,且在没有对其它生物制品或JAK抑制剂产生应答的患者中也能减少症状。
6、辉瑞/云顶新耀:Etrasimod
作用机制:S1P受体调节剂
适应症:溃疡性结肠炎
Etrasimod 是一种在研的每日一次口服的选择性鞘氨醇-1-磷酸(S1P)受体调节剂,正在开发用于治疗中重度活动性溃疡性结肠炎(UC)。Etrasimod 由最早Arena开发,辉瑞通过收购Arena获得etrasimod的开发授权,而云顶新耀于2017年从Arena获得了在大中华区和韩国开发、生产和商业化etrasimod的独家权利。目前,云顶新耀正在亚洲进行etrasimod治疗中重度溃疡性结肠炎的3期临床研究,预计将于2023年完成入组。在III期ELEVATE UC 52试验中,显示与安慰剂相比,接受etrasimod 治疗的患者在第12周和第52周临床缓解的协同主要终点方面均取得了统计学显著性改善;在第12周和第52周时,所有关键次要终点均显示出统计学显著改善。该药物的安全性特征与之前的研究(包括2期OASIS试验)一致。
Part.3
心血管领域
1、Cytokinetics:Omecamtiv mecarbil
作用机制:心肌肌球蛋白激活剂
适应症:射血分数降低的心力衰竭
Omecamtiv mecarbil是一款具有全新作用机制的选择性小分子心肌肌球蛋白激活剂,从2004年至今已经历18年研发,通过直接靶向作用于心脏的收缩机制,在收缩过程中结合并增加与肌动蛋白相互作用的心肌肌球蛋白头部区域的数量。Omecamtiv mecarbil旨在增加每个心动周期中的肌动蛋白-肌球蛋白活性横桥的数量,从而在射血分数降低的心力衰竭(HFrEF)患者中增强受损的心肌收缩力。然而,omecamtiv mecarbil(OM)的关键性III期临床数据好坏参半,根据2020年11月公布的III期(GALACTIC-HF)数据,显示与安慰剂+标准治疗相比,OM+标准治疗在降低心血管死亡或心力衰竭事件(心力衰竭住院和其他心力衰竭紧急治疗)的主要复合终点风险方面具有统计学意义,将复合终点事件的风险降低了8%(p=0.025),不过未达到延长心血管死亡时间的关键次要终点。2022年12月,FDA心血管和肾脏药物咨询委员会以8:3投票反对批准Cytokinetics,该药物治疗射血分数降低(HFrEF)心衰患者的潜在益处似乎并没有大于其风险,更新的PDUFA日期为2023年2月28日。
2、强生/ Idorsia:Aprocitentan
作用机制:靶向双重内皮素受体拮抗剂
适应症:高血压
Aprocitentan是一款靶向双重内皮素(endothelin)受体的口服拮抗剂,由Idorsia与杨森联合开发。Aprocitentan 是一种具有新型抗高血压机制的创新药物,适用于难治性高血压患者群体,可显著降低患者血压,且降压效果可维持近一年。Endothelin 信息通路控制血管的收缩,被发现与高血压病变相关,在顽固性高血压患者中经常被发现活化,目前并没有抑制此通路的疗法。2022年12月,Idorsia向FDA递交aprocitentan的新药申请(NDA),用以治疗顽固性高血压患者。该NDA的递交主要包含PRECISION临床3期试验的结果,数据分析显示:aprocitentan组患者的收缩压下降幅度均显著优于安慰剂;与其他高血压背景疗法联用时,可造成顽固性高血压患者血压在统计与临床上显著的下降;停药4周后,与安慰剂相比,接受aprocitentan治疗的患者收缩压持续降低,长达48周。
Part.4
皮肤科领域
1、Sun Pharma:CTP-543
作用机制:JAK1/JAK2口服抑制剂
适应症:斑秃
CTP-543(Deuruxolitinib)是一款JAK1和JAK2口服抑制剂,正开发用于治疗斑秃,预计于2023年上半年向美国FDA提交CTP-543的新药申请(NDA)。CTP-543由Concert公司开发,2023年1月,印度太阳制药(Sun Pharma)宣布收购Concert的所有流通股,获得旗下CTP-543的全球开发权。CTP-543是一种氘代鲁索替尼(ruxolitinib)类似物,具有不同的药代动力学特征。FDA曾经授予CTP-543的快速通道资格和突破性疗法认定,用于治疗斑秃。2022年11月,Concert公布deuruxolitinib在中度至重度斑秃成年患者中的3期临床试验数据,显示与安慰剂相比,接受deuruxolitinib治疗的患者在24周时头皮毛发再生有显著的改善。
Part.5
内分泌领域
1、Ascendis/维昇:TransCon PTH
作用机制:甲状旁腺激素
适应症:甲状旁腺功能减退症
TransCon PTH是一种每日一次长效甲状旁腺激素前药,旨在每天将PTH恢复至生理水平24小时,以解决该疾病的短期症状和长期并发症。目前,该药物在美国和欧盟被授予治疗甲状旁腺功能减退的孤儿药资格。该药物由Ascendis开发,维昇药业拥有TransConPTH在大中华区独家开发、生产及商业化上市的权益。该药物与传统的聚乙二醇化长效不同,在原型药物和大分子载体分子之间存在一个TransCon连接结构,当注射到人体以后,前药以可控速度解离,释放出原型药物,而载体和连接结构则通过肾脏排泄。这个过程既能起到药物缓释、控释的效果,又能避免大分子载体永久连接在活性药物分子上导致的组织亲和力和穿透力变差的问题。2022年10月,FDA已接受TransCon PTH用于成人甲状旁腺功能减退症的NDA,并进行优先审查, PDUFA的目标日期定为2023年4月30日。该NDA 的申请是基于全球 3 期 PaTHway 试验和 2 期PaTH Forward 试验的数据,以及公司正在进行的两项试验的开放标签扩展研究数据。
2、Madrigal:Resmetirom
作用机制:甲状腺激素受体β激动剂
适应症:非酒精性脂肪性肝炎
Resmetirom(MGL-3196)是一款潜在“first-in-class”甲状腺激素受体(THR)-β口服选择性激动剂。THR-β在肝脏中高度表达,且THR-β激动剂被证实在人体中具有降低低密度脂蛋白(LDL)、甘油三酯(TG)和肝脏脂肪变性的活性。通过促进脂肪酸的分解和刺激线粒体的生物发生,THRβ有助于减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。Resmetirom具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并且在肝脏部位被特异性摄取,对骨骼或心脏参数无影响,同时不影响甲状腺激素通路的其它激素。2022年12月,Madrigal公布了resmetirom 的关键 3 期MAESTRO-NASH临床试验的积极顶线结果,已经实现了FDA提出的两个肝脏组织学改善终点,可以合理地预测临床益处,以支持加速批准NASH肝纤维化治疗,预计在2023年上半年递交NDA。
Part.6
血液学领域
1、赛诺菲/ Sobi:Efanesoctocog alfa
作用机制:重组VIII因子
适应症:血友病A
Efanesoctocog alfa是是一种新型融合蛋白,基于创新的Fc融合技术开发,通过添加vWF的一个区域和XTEN®多肽来延长其在血液循环中的时间。Efanesoctocog alfa是一个克服半衰期限制的重组VIII因子产品,具有独特的结构,能够独立于vWF而稳定发挥作用,且半衰期延长至约47h,在一周一次的预防性治疗方案中,为一周的大部分时间提供接近正常水平的因子活性。相对于目前的VIII因子模拟疗法和仍在临床试验中的止血平衡疗法,Efanesoctocog alfa的主要优势是其能作为VIII因子的替代品用于治疗血友病患者的急性出血,并可通过标准实验室化验,以在必要时进行监测和剂量调整。一项III期试验结果表明,每周接受一次efanesoctocog alfa输注的血友病A患者的VIII因子谷值活性水平的平均值为15%,中位的年出血率为0。
2、Vertex/CRISPR:Exa-cel
作用机制:CRISPR/Cas9基因疗法
适应症:地中海贫血和镰状细胞病
Exagamglogene autotemcel(Exa-cel)是一款自体、体外CRISPR/Cas9基因编辑疗法,通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白(HbF),用于治疗输血依赖性β-地中海贫血(TDT)和严重镰状细胞病(SCD)。Exa-cel可以提高HbF水平,帮助缓解TDT患者的输血需求,并减少SCD患者的疼痛和血管闭塞性危象(VOC)。2022年11月,Vertex/CRISPR向EMA开始提交exa-cel的生物制剂许可申请(BLA)的滚动上市申请,预计将在2023年第一季度末完成提交。目前,exa-cel已经获得美国FDA授予的再生医学高级疗法(RMAT)、快速通道、孤儿药和儿科罕见病的称号认证,以及欧盟委员会的孤儿药认证、EMA的优先药物(PRIME)指定。根据在2022 ASH上公布的数据,接受exa-cel治疗的44名TDT患者中,42名维持不需要接受血红细胞输注;在接受exa-cel治疗的SCD患者中,所有患者均未出现SCD患者中常见的VOC。
3、武田:TAK-755
作用机制:重组ADAMTS13蛋白
适应症:血栓性血小板减少性紫癜TAK-755(apadamtase alfa)是由武田开发的重组ADAMTS13蛋白,通过替代缺失或功能失常的ADAMTS13酶,为TTP患者提供了一种靶向疗法。目前,TAK-755已经获得美国FDA的快速通道资格,用于预防和治疗先天性血栓性血小板减少性紫癜(cTTP)。cTTP是一种超级罕见的慢性凝血疾病,发病原因是由于ADAMTS13酶的缺失,导致血管性血友病因子(VWF)多聚体在血液中积累。这些VWF多聚体的积累导致血小板的聚集和粘连,造成小血管中异常凝血,并出现溶血性贫血和血小板减少症。根据关键性3期临床试验显示,与目前标准治疗相比,TAK-755将血小板减少事件发作频率降低60%。
Part.7
传染病领域
1、Innoviva/再鼎:SUL-DUR
作用机制:β-内酰胺酶抑制剂
适应症:鲍曼不动杆菌感染
SUL-DUR(Sulbactam durlobactam)是舒巴坦(一种静脉输注的β-内酰胺类抗生素)和durlobactam(一种新型广谱静脉输注的β-内酰胺酶抑制剂)创新的组合型药物,正在开发用于包括多重耐药和耐碳青霉烯类菌株在内的鲍曼不动杆菌-醋酸钙复合体(ABC)引起的感染。再鼎医药拥有在大中华区(中国内地、中国香港、中国台湾和中国澳门地区)、韩国、越南、泰国、柬埔寨、老挝、马来西亚、印度尼西亚、菲律宾、新加坡、澳大利亚、新西兰和日本开发和商业化SUL-DUR的独家授权。2023年1月,CDE已将注射用舒巴坦钠-注射用度洛巴坦钠组合包装用于治疗鲍曼不动杆菌(包括多重耐药和耐碳青霉烯类(CRAB)菌株)感染的新药上市申请纳入优先审评。在全球17个国家进行3期ATTACK注册性研究中,SUL-DUR实现了所有主要和次要终点。SUL-DUR新药上市申请已被FDA纳入优先审评,目标行动日期为2023年5月29日。
2、Nestlé/ Seres:SER-109
作用机制:微生物菌群
适应症:艰难梭菌感染
SER-109是一种由纯化的厚壁菌门孢子组成的微生物组治疗剂,用于治疗复发性艰难梭菌感染。该药物先后获得FDA突破性治疗和孤儿药认定。SER-109的有效成分来自被“提纯”的人类粪便,经过乙醇处理,杀死其中大多数病毒、真菌和繁殖体细菌后,保留那些拥有较厚细胞壁的细菌孢子。厚壁菌门细菌能够在肠道中与艰难梭菌竞争营养和碳源,并且可以促进肠道中的初级胆汁酸转化为次级胆汁酸,后者能抑制艰难梭菌的生长繁殖。在一项3期、双盲、随机、安慰剂对照试验,将经过标准的抗生素治疗后的患者,随机分配SER-109或安慰剂,结果显示:SER-109组和安慰剂组复发艰难梭菌感染患者的百分比分别为12%和40%,SER-109导致复发频率低于安慰剂。大多数不良事件为轻度至中度,为胃肠道不良事件,两组的数量相似。
3、Cidara/Melinta :Rezafungin
作用机制:棘白菌素抗真菌药
适应症:念珠菌血症和侵袭性念珠菌病
Rezafungin是一种新型的,一周一次的棘球白素,其结构和特性经过改进,保留了棘球白素类药物的安全优势,同时增强了其药代动力学和药效学特性,开发了一种更持久的下一代治疗和预防药物。2023年1月,Cidara 和Melinta宣布,FDA 抗菌药物咨询委员会以14:1 赞成批准抗真菌新药rezafungin上市,用于治疗念珠菌血症和侵袭性念珠菌病。该投票是基于全球ReSTORE 3期临床数据和STRIVE 2期临床试验数据,显示每周一次给药rezafungin,与目前每天给药一次的标准疗法caspofungin相比,具有非劣效性。FDA决定的PDUFA日期为2023年3月22日。EMA于2022年8月接受了rezafungin的MAA,目前正在审查中。此前,rezafungin已在美国获得合格传染病产品资格(QIDP)、快速通道资格和孤儿药资格。
Part.8
代谢领域
1、Krystal:VYJUVEK
作用机制:基因疗法
适应症:营养不良性大疱性表皮松解
VYJUVEK(beremagene geperpavec)由斯坦福大学与 Krystal共同开发,是第一个临床开发中的非侵入、局部、可重复基因疗法。在一项双盲、安慰剂对照,共入组 31 名患有隐性营养不良性 EDB 的儿童和成人的III期研究中,显示:使用VYJUVEK 3 个月后,71% 接受基因治疗凝胶的伤口完全愈合, 20% 接受安慰剂的伤口完全愈合;6 个月后,67% 接受基因治疗凝胶的伤口完全愈合, 22% 接受安慰剂的伤口完全愈合,达到了主要终点目标。Krystal计划在 2022 年上半年向 FDA 递交BLA,随后向欧盟递交MAA。
2、Cyprium:CUTX-101
作用机制:Cu补充剂
适应症:Menkes病
CUTX-101是治疗Menkes病的一种潜在疗法,正在被开发用于补充经典Menkes病患者血液和大脑中的铜水平。Menkes病是一种由铜转运蛋白ATP7A基因突变导致的X连锁隐性儿科疾病,每年影响约1/100000的新生儿。从生化角度看,该病患者血液和大脑中的铜水平较低,某些神经化学物质的含量也不正常。该病拥有独特的临床特征,包括头发稀疏和褪色、结缔组织问题,以及严重的神经症状,比如癫痫、张力减退和发育不良。该病死亡率较高,如果不进行治疗,许多患者会在3岁前离世。目前,Menkes病及其变异型尚无获得FDA批准的治疗方法。该药物已被FDA授予治疗Menkes病的儿科罕见病资格认定、孤儿药和快速通道资格认定。研究表明,与未治疗的自然病程对照(HC)队列相比,接受CUTX-101早期治疗(ET)的Menkes病受试者的总体生存率有统计学意义的提高,死亡风险降低了近80%(危险比=0.21,p<0.0001)。ET组的中位生存期为14.8年(177.1个月),而未经治疗的HC组为1.3年(15.9个月)。

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 48
48

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-01
2025-05-01
 49
49

 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-05-01
2025-05-01
 47
47