 产业资讯
产业资讯
 智药局
智药局  2023-04-27
2023-04-27
 2048
2048
药物在临床试验的表现,往往可以改变人们对于某一靶点、某一技术甚至某一领域的看法,很多时候也是决定一家公司未来的命脉所在。
不幸的是,如此重要的事情,却拥有着比赌博更高的风险。
Biotechnology Innovation Organization做过一个统计:2011-2020年,药物开发项目从1期临床到获得美国FDA批准上市的成功率平均为7.9%。
极低的成功率使得各大医药媒体的版面上总是挤满了进展不顺的临床管线报道,但似乎除了相关公司股价应声下跌外,再没有更多后续。
面对效果不佳、试验暂停甚至终止的管线,我们是否能够从中获取些许启示?
智药局为此梳理了近一年以来99条临床进展不及预期的管线(不完全统计),尝试从中得出一些自己的看法,希望能为业内人士带来帮助。
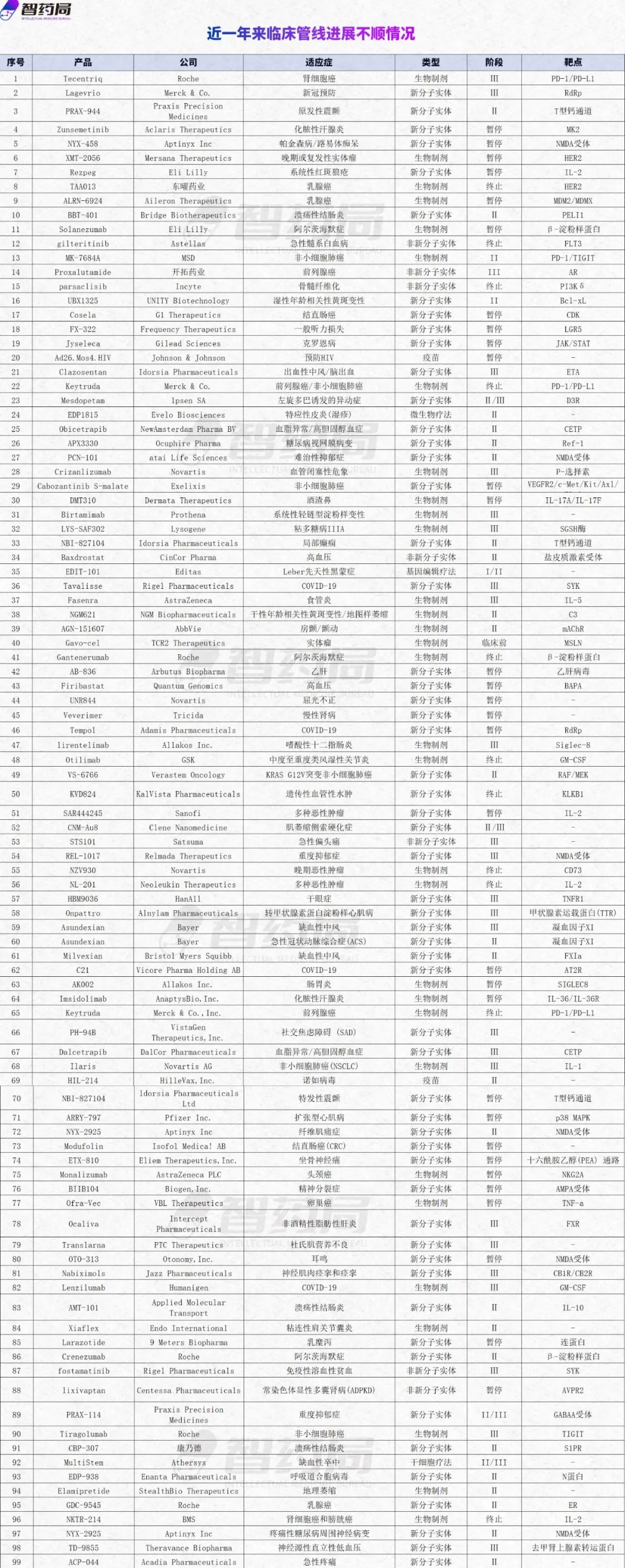
PD1/PDL1高烧不退
自2014年PD1/PDL1单抗面世以来,以Keytruda(K药)、Opdivo(O药)为代表的免疫药物,攻克了一个又一个适应症,掀起了肿瘤治疗的革命,围绕PD1/PDL1的临床试验自然也水涨船高。
去年发表在Nature Reviews Drug Discovery上的一篇报告用数字为我们展现了PD1/PDL1抗体临床试验的火爆情况:共有5683项临床试验正在评估PD1/PDL1单抗作为单药疗法或与其他疗法联合使用,其中4897项处于活跃状态,2017-2021年临床试验总数增加了278%。
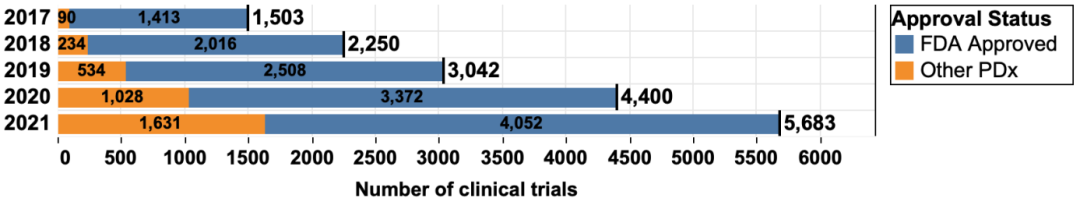
图:2017-2021年PD1/PDL1抗体临床试验增长情况
如此庞大的临床数量在催生着一个又一个成就的同时,也不可避免地遇到接连不断的挫折,这一点,连MNC的明星药品也不能免俗。
今年2月,默沙东宣布其大名鼎鼎的“K药”联合恩扎卢胺与雄激素剥夺疗法(ADT)的组合疗法在针对转移性去势抵抗性前列腺癌和酪氨酸激酶抑制剂(TKI)耐药、表皮生长因子受体(EGFR)突变转移性非鳞状非小细胞肺癌两项III期研究均未达到共同主要终点。
在中期分析中,与安慰剂组相比,帕博利珠单抗组没有显示出在共同主要终点影像学无进展生存期(rPFS)或总生存期(OS)上的改善,并且越过了预先指定的OS无效边界。根据独立数据监测委员会的建议,默沙东将终止此项研究。
此前,该组合疗法在治疗转移性激素敏感性前列腺癌(mHSPC)时也遭到挫折:1月25日,该组合治疗转移性激素敏感性前列腺癌(mHSPC)患者的III期KEYNOTE-991研究也未达到改善OS和rPFS的主要终点,因此默沙东决定终止这项研究。
无独有偶,去年7月,罗氏制药业务负责人Bill Anderson在投资者会议上透露, Tecentriq在肾癌辅助治疗的研究中未能达到主要终点。
作为全球首款获批上市的PD-L1单抗,Tecentriq目前在全球获批的适应症主要包括膀胱癌、晚期/转移性非小细胞肺癌、三阴性乳腺癌、小细胞肺癌、肝细胞癌、黑色素瘤等,尚未在肾细胞癌适应症上拿到上市资格。
尽管明星药品在拓展适应症的过程中遇到一些障碍,但这并不能阻止各大药企想要进军PD1/PDL1分一杯羹的热情。
毕竟实在是太香了。
2022年,Keytruda为默沙东贡献了209.37亿美元,同比增长22%,虽不及Humira去年212.37亿美元的销售额,不过从趋势来看,K药登上“药王”宝座只是时间问题。
榜样在前,巨大的经济效益激励着创新药企们前赴后继。
阿尔茨海默:道阻且长
阿尔茨海默病(AD)是一种导致痴呆的进行性神经退行性疾病,不仅对患者记忆、思维、行动能力产生影响,而且会导致病人残疾并大幅缩短生存期,目前全球患者超过5500万人,其中我国患者超过1000万。
庞大的患者数量给无数家庭带来痛苦的同时,也为社会带来沉重负担:根据美国管理医疗杂志统计,2021年美国AD相关的护理和治疗总费用高达3210亿美元,艾昆纬预估到2030 年,全球用于痴呆症的费用将达到2.54 万亿美元。
如此重大的疾病,目前却尚无有效治疗的方法,究其原因,症结在于AD仍不清晰的病因和分子生物学病理。
针对AD发病机制,学界存在多种假说,其中Aβ(β-淀粉样蛋白)学说是近年的主流学说(尽管存在争议)。
该学说认为β-淀粉样蛋白沉积形成淀粉样斑块是AD的主要致病因素之一,通过选择性结合以消除可溶性、 有毒的β-淀粉样蛋白聚集体,被认为是有效治愈AD的可行方法。
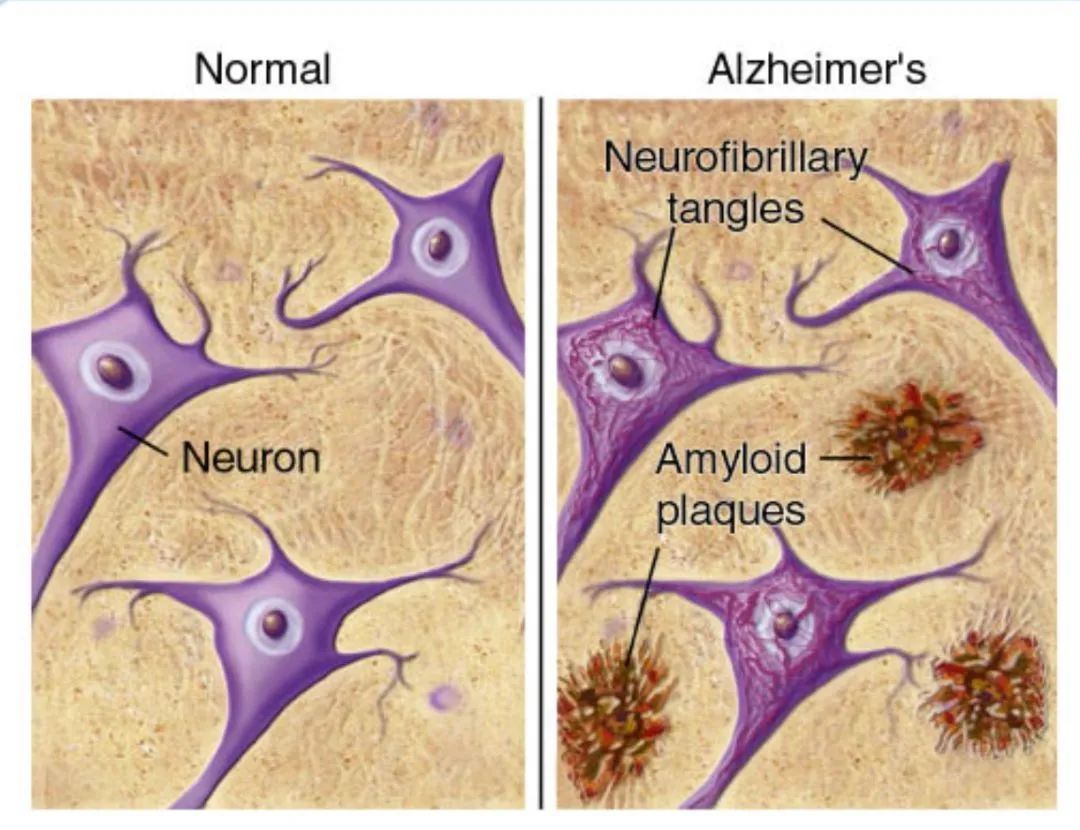
图:正常人脑部与阿尔兹海默患者脑部对比
基于该学说中的关键靶点β-淀粉样蛋白,目前业内开发了多款药物,其中两款药物已被FDA批转上市。
2021年6月,来自渤健/卫材的Aduhelm获得FDA有条件加速批准用于治疗AD,成为近20年来FDA首次批准治疗AD的新疗法。今年1月,FDA加速批准由卫材/渤健联合开发的Lecanemab用以治疗AD。
不过上述两款已上市药品的前景不容乐观。
此前被寄予厚望的Aduhelm因疗效、定价等问题遭受质疑而在市场上惨败,从2021年上市到2022年Q3,该产品仅收入750万美元。
而与Aduhelm同机制的升级版产品Lecanemab,也因近期接连出现三名患者疑似因接受Lecanemab治疗后导致死亡而备受质疑。
不仅如此,多款靶向β-淀粉样蛋白的抗体也在临床试验阶段进展不顺。
今年3月,礼来宣布停止其AD治疗候选药物Solanezumab的开发,原因是其III期A4研究未达主要终点和关键次要终点,临床试验显示该候选药物未能获得显著效果。
这意味着礼来耗时十年所推动的Solanezumab临床试验研究又一次遇到挫折。
除了礼来,近期罗氏在这一领域也遭受连续打击。
去年11月,罗氏公告其皮下注射β-淀粉样蛋白单抗Gantenerumab在两项治疗早期阿尔茨海默症的三期临床GRADUATE I&II中均未能达到主要临床终点,这是罗氏短期内遭受到的第二个打击。
此前,于去年6月,罗氏与班纳阿尔茨海默病研究所联合宣布,抗β淀粉样蛋白单克隆抗体Crenezumab在预防常染色体显性阿尔茨海默病(ADAD)的临床II期试验未能达到主要终点,不能显著减缓或预防认知功能下降。
上市药品不佳的市场表现与临床试验的诸多不顺,让人们不得不重新审视β-淀粉样蛋白与AD之间的关系,而随着学界对AD的了解更加深入,出现了很多新靶点,包括线粒体功能障碍变化,神经炎症途径,脑内神经营养因子,氧化应激途径等。
可以确定的是,未来针对AD的新药研发将会迎来更多意料之外的喜与悲。
NMDA受体能改变CNS治疗吗?
AD药物研发的窘况,实际上是其所属的CNS(中枢神经系统)疾病的一个缩影。
长久以来,CNS疾病就以致病机制复杂、靶点难以成药、实验设计困难、模型可靠性低、患者对安全性和依从度要求高等因素阻碍着新药研发。
塔夫茨大学药物开发研究中心曾对1995-2007年期间的274种CNS药物和1168种非CNS药物临床进行研究分析,发现FDA最终批准上市的CNS药物的成功率不到非CNS药物批准率的一半(分别为6.2%和13.3%)。
比一般疾病领域更高的失败率也曾一度吓退包括辉瑞、安进、BMS、GSK和阿斯利康等一众MNC。此前英国制药工业协会的一份报告显示,相较于全球有38%的研发资金投入到肿瘤和免疫治疗领域,CNS领域只吸引了仅7%的资金。
虽然被称为“新药研发黑洞”而遭冷遇多年,但没有人否认以AD、PD(帕金森病)、抑郁症等为代表的CNS疾病背后巨大的市场价值。
近年来,随着人们对神经科学理解的加深,药企对CNS这片蓝海的热情正在回归。
去年8月,一则消息轰动了CNS圈:FDA批准Axsome Therapeutics的Auvelity用于治疗成人重度抑郁症(MDD),这是首款也是目前市唯一一款用于治疗成人重度抑郁症的口服速效N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,被认为是60年来临床治疗抑郁的新机制药物。
Auvelity的成功上市,为针对以NMDA受体为代表的针对CNS疾病的新兴靶点的药物研发注入一剂强心针。
NMDA受体的全称为N-甲基-D-天门冬氨酸受体,是一种特殊类型的谷氨酸神经递质离子型受体,在调节多种神经功能中起着至关重要的作用,包括呼吸、运动、学习、记忆形成和神经可塑性。
因此,NMDA 受体的结构和功能对多种中枢神经系统 (CNS) 疾病重要意义,包括阿尔茨海默病、帕金森病、亨廷顿病、神经性疼痛、抑郁、癫痫和精神障碍等。
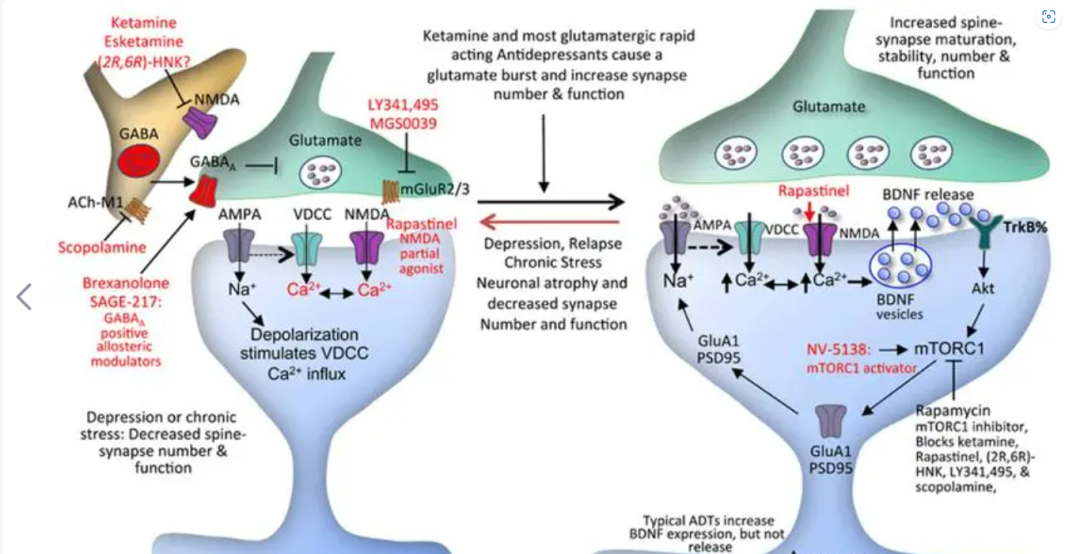
图:速效抗抑郁药的初始细胞靶位点和随后的突触变化
目前既有众多以NMDA受体为靶点的CNS疾病药物进入临床阶段,以抑郁症为例,进入临床的管线就超过20条。
不过,随着临床试验的加快推进,NMDA受体相关药物也不可避免地在临床试验多处碰壁。
今年2月,Aptinyx公布了一项公司研发的一款新型口服 NMDA 受体阳性变构调节剂NYX-458 的Ⅱ期临床研究的结果,结果显示,针对与帕金森病和路易体痴呆相关的认知障碍患者的影响,与安慰剂相比,NYX-458 并未证明其在终点方面有临床意义的改善。
去年,这家公司的另一款新型口服 NMDA 受体正向变构调节剂NYX-2925也宣告在治疗疼痛性糖尿病周围神经病变和纤维肌痛的两项 IIb 期研究均未达到研究的主要终点。
接二连三的失败让这家公司的股价一路暴跌,从最高点的32.25美元跌去99.9%,目前每股价格仅为0.125美元。
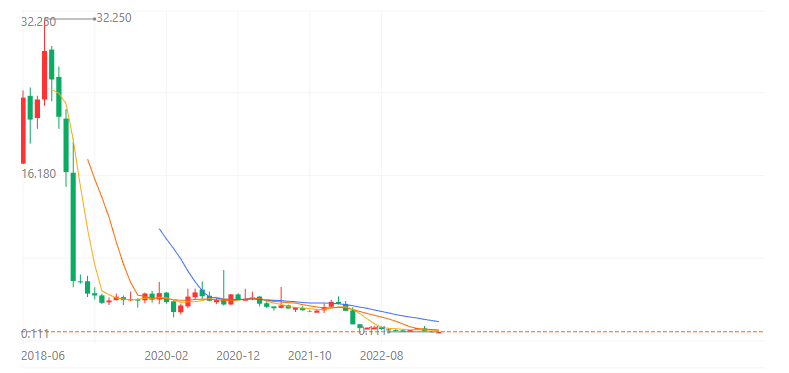
图:Aptinyx股价图
此外,今年年初,ATAI Life Sciences宣布公司研发的非竞争性的NMDA受体拮抗剂PCN-101治疗难治性抑郁症(TRD)的临床IIa期研究未达到其主要终点。
好消息是,虽然相关药物在临床试验遭遇挫折,但人类对于NMDA受体的理解正在一步步加深,新技术的出现和应用,正在加速这一过程。
近期,中科院脑科学与智能技术卓越创新中心竺淑佳组一篇研究论文发表在Nature子刊Nature Structural & Molecular Biology上。
该研究结合单颗粒冷冻电镜、质脂体单通道记录、电压钳记录、分子动力学模拟、质谱分析、生化验证等多维度技术,揭示了含GluN2D亚基NMDA受体的门控机制和功能特征,诠释了含GluN2C亚基NMDA受体的不对称几何构象及特异性变构调节的机制,为深度理解NMDA受体不同亚型的功能多样性及开发亚型选择性的小分子药物提供了理论基础。
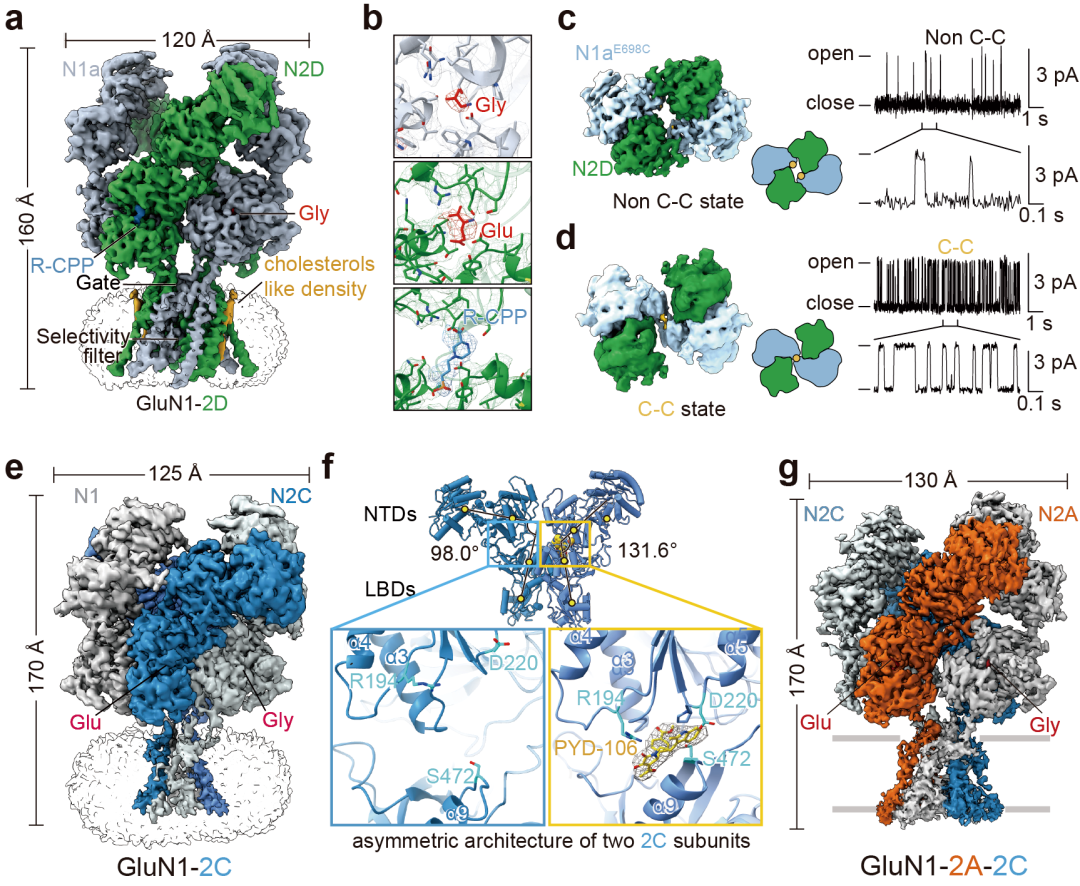
图:含有GluN2D和GluN2C受体的三维结构、门控机制和药理学特性。
而该研究成果的发表离不开AI等新技术的助力,资料显示,深势科技的三位研究人员负责本次研究的分子动力学模拟和能量计算。
有理由相信,在新技术的推动下,CNS在未来也将迎来更多的创新药物,这一困扰3亿患者的重大公共卫生问题有望得到解决。
写在最后
从当下算起,过去的一年时间里,制药行业普遍低迷。
寒冬之下,临床管线的失利往往成为药企不可承受之重。
对于Biotech而言,一条临床管线的不顺往往可以决定企业的生死,而对于 Biopharma和Bigpharma来说,市场对于试错的包容度也在降低。
在此情况下,梳理和回顾过去一年以来的失败案例,就显得十分必要。
与其他领域有所不同,在制药领域,进展不顺是大概率事件,连国际巨头也不能逃过这条铁律。
如此情况下,如何以更加理性的视角看待失败并坚持探索,成为区分一家药企未来能否脱颖而出的核心品质。

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 48
48

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-01
2025-05-01
 49
49

 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-05-01
2025-05-01
 47
47