 产业资讯
产业资讯
 医药魔方Plus
医药魔方Plus  2023-05-10
2023-05-10
 2182
2182
中国的创新药投资似乎越来越面临一种“不知道该投什么”的困境。有意思的是,这个困境甚至是因为研发水平整体进步带来的。
十多年前国内谈创新药投资(其实也包括医疗器械),进口替代是最大的逻辑:fast follow & 赛道前三就足够打动各家投委。今时不同往日,国内新药研发水平无疑已经大幅进步,随之而来的是门槛也大幅降低,然后就是一个字:卷。
好吧,既然“跟随美国公司已经做过的方向”的投资策略变得似乎人人都能做,这条路肯定不大行得通了。倘若如此,去投那些“美国公司还没有做过的方向”呢?
不出意外的话,投资经理们会在投决会上被IC这么怼:“中国创新药公司实力超过美国了吗?好像没有吧,那么美国公司都没做的,你告诉我中国公司为什么能做出来?”好像还挺理直气壮。
等等,美国做了的,中国再做肯定卷;美国没做的,中国又肯定做不出来……这么两头堵好像没活路了。
创新从何而来:能不能,还是要不要?
我们先来看另一个问题:什么是Biotech能做,Big pharma不能做?
众所周知,相较绝大多数Biotech而言,Big pharma在资金实力、人才储备和临床数据积累方面无疑是有着全方位碾压的优势。可真正大比例的创新药产出,源头仍然是Biotech。
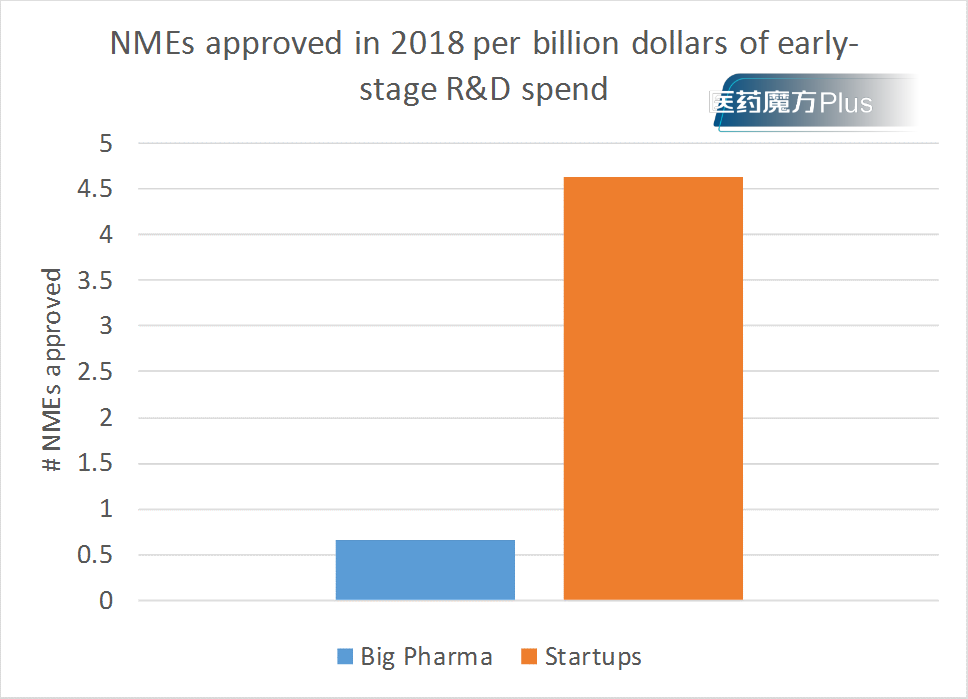
图1 Big pharma 与Biotech创新研发效率比较
Big pharma机制僵化,似乎是一个经常用来解释的理由。尽管如此,决定行动的Big pharma动作丝毫不慢,譬如帕博利珠单抗赢下NSCLC的临床速度。事实上任何Biotech都明白,若是同一靶点,但凡前景明确,睁开眼睛的Big pharma砸人砸钱绝不含糊。除非Biotech已在临床拉开足够的时间差,否则竞争起来,临床前研究领先的那点时间根本不够。
如果把格局继续打开,会发现互联网行业亦是如此。从Google到Facebook、Twitter,也包括国内如今日头条、抖音、美团等这些,初诞生时的产品形态对彼时的行业巨头而言,做出类似东西可谓毫不费力,可实际最终情形往往演变为某大佬形容的四阶段:看不见、看不起、看不懂、跟不上。
由此可见,对于“创新会由谁做出来”这个问题,恐怕不在于“能不能”,而在于“要不要”。对Biotech VS Big pharma如此,对创新药研发的中美对比亦是如此。
创新药无人区:远比想象的更多
更重要的在于,相较于互联网、芯片和新能源等行业相对集中的创新模式,新药研发的创新机会明显要分散得多,根本原因在于疾病种类多样带来临床需求的多而散。更重要的是,现有的创新药研发仍然存在大量的无人区。
以肿瘤药为例,2017年发表在NRD的一篇综述做过这样一项分析。在FDA批准的154款抗肿瘤药物(包括细胞毒类药物)中,总共涉及了109个靶点。现有肿瘤基因表达产物,大概有553个。尽管如此,这两项的交集只有区区30个。这意味着在已知的肿瘤基因相关产物中,近95%并没有被开发成药。数字之大,有点令人意外,而这还仅仅只是已知的肿瘤基因产物。
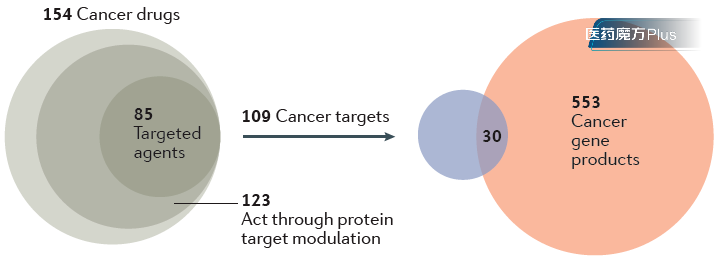
图2 肿瘤药物靶点和肿瘤基因产物重叠情况分析
这足以表明,现有的欧美主导的创新药研发仍然存在大量有待探索的创新无人区,包括疾病、靶点、方向。肿瘤领域的胃癌、肝癌等东方人群的大癌种便是典型,十余年前的HBV亦是如此。美国没有做,欧洲没有做,Big pharma没有做,跟这个方向究竟能不能做出来,是不是禁区,没有必然联系。
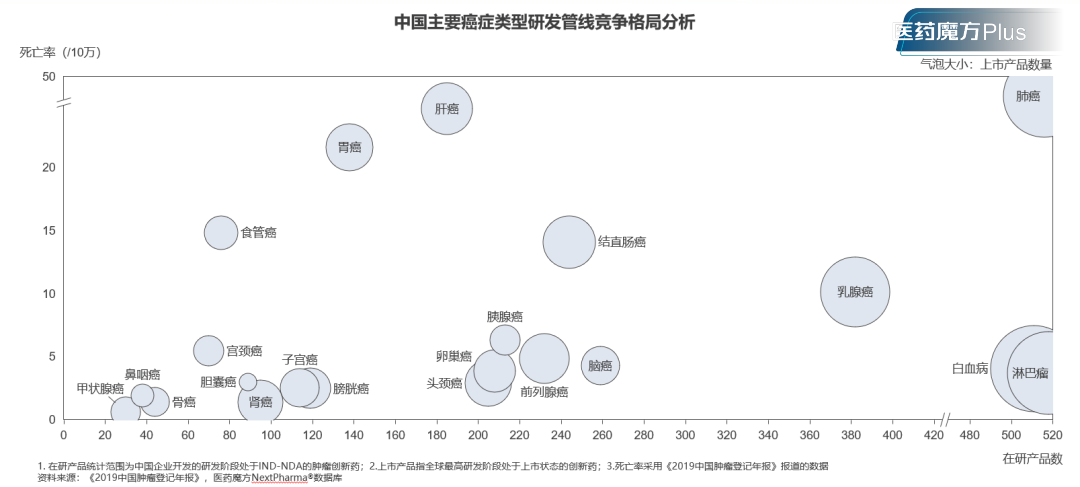
图3 中国主要癌症类型研发管线竞争格局分析(数据来源:医药魔方)
不仅“没有做的”不是禁区,有太多“主动放弃的”也不是禁区。欧美Biotech拿下Big pharma放弃的项目,最终研发成药的品种大有所在。最近的例子大概是Biohaven,2016年拿下BMS放弃的两款偏头痛药物Rimegepant和 Zavegepant,重启临床并开发成功后,2022年公司被辉瑞以116亿美元并购。
甚至那些后来取得成功的明星药物,研发过程也是九死一生,无论是CDK4/6抑制剂哌柏西利,或是BTK抑制剂伊布替尼、阿卡替尼,研发过程都遭受了无数质疑和冷眼,数次险些胎死腹中。这些后来的白天鹅们,在早期真真切切看起来就是个丑小鸭。
降低无人区探索的风险:疾病生物学证据
探索无人区的收益是巨大的,当然风险也是不言而喻的。否则不会如此众多的新药研发者和投资人对此畏缩不前,毕竟大家都是聪明人。
话说回来,创新药研发本身就是富贵险中求的生意,要么是科学风险,要么商业风险,总得承担一个,甘蔗没有两头甜。如果明确没有能力或者意愿去承担商业“卷”的风险,那面对另一头的科学风险,咬咬牙也得上。
尽管如此,这并不代表我们只能闭着眼睛去撞大运。科学风险虽然不可能完全避免,但我们依然可以有途径尽可能降低。对创新药而言,这个途径非常明确,就是疾病生物学机制研究。
一个陌生蛋白,基于哪些证据可以作为创新药开发的靶点?通常可以想到的:分子层面,包括分子信号通路(TKI最常见思路),转录、翻译或者更新一点,表观遗传修饰。复杂一点到细胞层面,各种功能细胞类型激活和抑制(近年IO 抑制剂或激动剂常见思路),进而是各种动物模型验证。
这大概就是过往十余年,国内创新药投资人听到介绍最多的立项依据(当然fast follow还应该全面介绍同靶点已有临床项目开展的情况,尽管很多避而不谈)。
这些当然是重要的生物学证据,可是还不够。更重要的在于这个陌生蛋白,在疾病生物学机制层面,还有哪些证据:
我们的药物开发希望解决什么疾病?
这个陌生蛋白,既往相关基础生物学机制发现,多大程度在这些疾病的临床研究中得到确认?
目标疾病的哪些适应症有机会作为具体开发方向?
适应症特征能否进一步分型:亚型,治疗阶段,病理特征,用药史,等等?
陌生蛋白在目标适应症的表达丰度如何,是否有直接证据?
陌生蛋白的表达情况,与目标适应症的预后是否看到负相关?
患者特征能否进一步分型:地域、人种、biomarker,等等?
如何从疾病的发生和演变,从患者的组织微环境和机体等各层面,解释靶点和疾病的关系?
是否能找到一些遗传学(突变人群)相关证据,解释该目标蛋白在人体的可能作用机制?
类似这些,疾病生物学机制相关的证据,或许是过往国内创新药研究最为忽略的地方了。

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 6
6

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 6
6

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 9
9