 产业资讯
产业资讯
 医药经济报前沿观察
医药经济报前沿观察  2023-05-31
2023-05-31
 2599
2599
长期以来,痛风一直是药物开发商默默耕耘的领域。但5月中旬,这一疾病治疗成为行业关注焦点。原因在于,美国联邦贸易委员会(FTC)在反对批准安进收购Horizon公司时指出,Horizon生产的痛风药物Krystexxa具有垄断性。
对行业的痛风研发线进行考量,似乎可以为FTC的立场提供一些支持。在慢性痛风治疗领域,目前只有一个研发项目可能会很快向Krystexxa发起挑战,即Selecta和Sobi公司的SEL-212,该药预计明年向监管机构提交上市申请。除此之外,这一领域的研发工作主要由亚洲开发商进行,且研发项目以区域为重点。
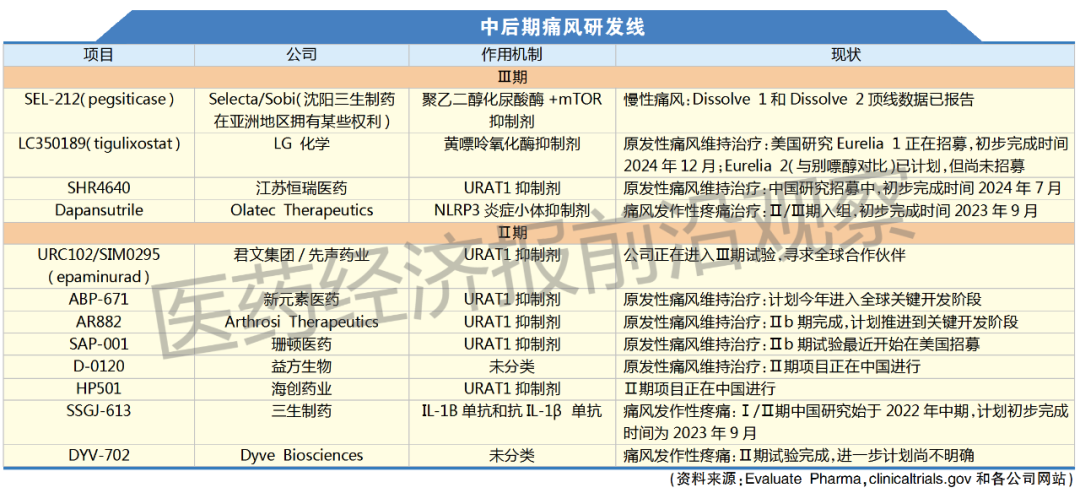
聚焦亚洲元素
痛风可以采用不同的药物进行治疗,这取决于疼痛性关节炎的发展情况。但是,药物毒性在所有治疗阶段都是一个普遍存在的问题。别嘌醇(Allopurinol)是一只有50年历史的痛风老药,对于不再使用止痛药或类固醇的患者,该药仍然是一种主要治疗药物。但是,别嘌醇会引起严重的超敏反应,尤其是亚裔和黑人人群。一般来说,亚裔人群患痛风的风险更高,这或许可以解释为什么亚洲有大量药企正在从事相关的研发工作。
这些研发项目中,大多数都在寻求向市场提供别嘌醇或非布司他的替代性治疗产品。非布司他是一种通用型黄嘌呤氧化酶抑制剂(XOIs),通过减少身体产生的尿酸而起作用。非布司他在失去专利保护之前由武田公司以Uloric的品名销售,但自2019年以来,该药一直携带黑框警告标志,提醒患者服用该药可能会因心脏问题而导致死亡风险的增加。
在亚洲,大部分开发工作集中在发掘更加安全的XOIs。西方开发商在这一领域几乎缺席,这可能是因为一系列令人失望的事件压制了它们的兴趣,以及早期疗法已经进入了高度仿制化的市场。
以Krystexxa为例,尽管它是最畅销的痛风品牌药物。该药繁冗的研发历程曾导致Savient公司破产,后几经转手落到Horizon公司的手中。Ardea公司开发的Lesinurad被阿斯利康以12亿美元收购,最终却没有带来回报。Lesinurad是一种URAT1抑制剂,由于该药可能与肾衰竭存在关联,FDA要求其开展上市后研究,2016年被当时的所有者Ironwood公司撤出市场,这进一步降低了其对抗廉价仿制药XOIs发展前景的预期。
寻找更加安全的URAT-1抑制剂正在进行之中,江苏新元素医药科技有限公司(Atom Bioscience)可能很快就会加入后期研发行列,该公司声称其相关Ⅱ期研发项目没有出现严重的副作用,计划今年启动一项全球关键性项目。江苏恒瑞的一款URAT1抑制剂已经进入Ⅲ期试验阶段,但目前尚不清楚该项目是否将针对国外市场进行开发。
韩国的LG化学和中国的珊顿医药(Shanton Pharma)也表达了进军全球的雄心。它们可能会面临与lesinurad的开发商相同的商业挑战,尽管它们都声称拥有更加安全的选项。
但不管怎样,Krystexxa仍有望在一段时间里领衔慢性痛风的治疗市场。
寻找更安全产品
痛风是一种代谢性关节炎,由尿酸在关节中积聚所引起,会导致严重的炎症和疼痛,并形成被称为痛风石的损容性肿块。基于尿酸酶的治疗产品可以分解关节中导致痛风石的尿酸盐结晶,它们已经被开发用于难治性或慢性痛风。在这个阶段,患者对XOIs的治疗不再作出反应。然而,开发尿酸酶之类的产品供患者长期使用已经被证明并非易事。
Krystexxa是第一个被证明有疗效的聚乙二醇化尿酸酶,但其上市销售携带了冗长的黑框警告信息,表明有可能引发过敏反应、输液反应以及与葡萄糖-6-磷酸脱氢酶(G6PD)缺乏相关的溶血和高铁血红蛋白血症。
患者使用这种药物前,需要预先使用抗组胺药和静脉注射类固醇,每两周静脉注射1次,时间至少长达2小时。除了过敏反应的风险以外,在治疗的前几个月里,它还经常导致痛风发作增加。尽管如此,Krystexxa今年的销售额仍有望达到8亿美元。
市场无疑在期待更加安全的基于尿酸酶的治疗产品,即使出现的产品没有在Krystexxa治疗功效的基础上加以改进,仍然可能会有市场需求。来自两项关键性试验的顶线结果表明,Selecta和Sobi的SEL-212可能达到要求,不过,相关的完整试验数据尚未公布。
SEL-212含有聚乙二醇化重组尿酸酶,结合了Selecta公司的免疫耐受技术,被称为ImmTor免疫耐受平台,据说可以降低免疫原性。在接受Krystexxa治疗的大约40%的患者中检测到了抗药抗体(ADA),这些抗体降低了该产品的功效,并导致发生严重的过敏反应。
一项交叉试验比较表明,高剂量的SEL-212与Krystexxa之间的治疗反应率相似。在Dissolve试验中,47%~56%的患者满足主要的反应标准,而在Krystexxa的药品标签上,反应率为38%~47%。
Krystexxa联合甲氨蝶呤时以反应率71%胜出,尽管这并不是所有患者会选择的治疗方案。
此外,与安慰剂组相比,使用SEL-212的患者没有报告痛风发作的增加。不过,在整个项目中,发现了两例过敏反应。
这些研究数据是否达标将很快由监管机构做出评判。瑞穗公司分析师估计,SEL-212在美国市场上的销售潜力在5亿~10亿美元之间,但值得注意的是,这一研发项目此前曾让人失望,在一项Ⅱ期研究中它未能击败Krystexxa。
还有一些开发商正在寻求解决痛风发作相关的疼痛。诺华开发的 Ilaris在欧洲获得了批准,不过,FDA长期以来一直拒绝批准这种白细胞介素治疗痛风的方法,诺华和再生元相关产品为此都遭到了拒绝。
PD-1激动剂会是自身免疫疾病治疗曙光吗?
作者:黄晓丽 综合编译
如果在T细胞上阻断PD-1如同释放免疫系统的手刹,并为癌症治疗带来重大变革,那么反过来激活PD-1,就可以让免疫反应停止作用,并尝试将其用于自身免疫性疾病治疗。该观点在业界出现已经有一段时间了,近日,礼来PD-1激动剂抗体peresolimab治疗类风湿性关节炎(RA)有效的Ⅱa期临床数据发表在《新英格兰医学》杂志(ENJM),这是全球首款PD-1激动剂抗体。其阶段性研究成果似乎进一步佐证了以上猜想。
不过,这样一个机械性的方法是否会让肿瘤绕开免疫系统,使患者患癌风险变高?这是PD-1激动剂开发绕不过的问题。
该问题在最近ENJM的一篇社论被提及,该文章详细报道并讨论了礼来peresolimab研究的相关数据,“因为这个治疗方法并非抗原特异性,令人最担忧的是癌症的发生,并且可能在试验短期内还无法被确认。”
肿瘤避开免疫系统的风险是否增加?这是抑制了免疫系统的治疗方法在理论上成立的风险,逻辑上需要12周以上的时间才会显现。
此外,目前的RA药物在停用后效果往往会减弱,PD-1激动剂是否可以“重新调整免疫反应”,提供一个更长期的治疗方法也值得深入研究。
后续还有几个PD-1激动剂项目将会对此理论作出测试。
其中比较有潜力的是Anaptysbio公司的rosnilimab,rosnilimab将在第三季度进入用于RA的Ⅱ期试验。2021年的Ⅰ期研究展示了rosnilimab持久的PD-1受体占位和“良好的安全性和耐受性”,并开启了斑秃治疗研究的Ⅱ期试验,然而,该领域研究暂无结果,Anaptysbio便转而研究RA治疗。
Anaptysbio还有一个PD-1激动剂资产CC-90006,原本是与Celgene合作研发的,但百时美施贵宝在Ⅰ期后中止了该项目。
默沙东以19亿美元收购Pandion之后,PD-1激动剂PT627和PT001也随之而来,PT627可以全身性给药。虽然默沙东并未过多谈论这两项资产,但目前PT101(MK-6194)Ⅰ期试验已经开启。
除了默沙东,吉利德与Ibio公司同样通过收购获得了PD-1激动剂资产:吉利德去年8月以4.05亿美元收购了Microbio并获得MB151;而Ibio则以100万美元预付款收购Rubryc获得RTX-002。其相关研究都还处于临床前试验阶段。
Ono公司的ONO-4685不是PD-1激动剂,而是一种抗PD-1/CD3双特异性抗体,通过T细胞的自相残杀而消除该细胞,以此减少自身免疫反应。然而,其针对斑块状银屑病的Ⅰ期研究已被暂停,究其原因很可能是毒性问题。对PD-1激动剂毒性的担忧在短期内也将持续。
尽管礼来已经将peresolimab投入到一项大型RAⅡ期研究Resolution-1中,该试验对三组剂量下的ACR20(改善20%)进行测试,并与安慰剂组做对比。根据ENJM文章,700mg剂量接受者有71%的ACR20,300mg剂量是44%以及安慰剂组是42%。但接下来试验的必要性将由FDA决定,这样才能给安全问题带来足够的信心。
口服减肥药研究喜讯频传
作者:许关煜 李敏华
5月22日,诺和诺德表示其热销的肥胖药物口服版本在第三阶段试验中取得了成功,其减肥效果与注射剂测试结果相当。在这项研究中,超重或肥胖患者在服用该药68周后,平均体重减轻了15.1%,而安慰剂组的体重减轻了2.4%。这一结果与该公司以Wegovy商品名出售的每周注射版本的药物semaglutide(索马鲁肽)结果相似。
该研究结果在Wegovy获批2年后得出;5年前,Ozempic获批治疗糖尿病,但也被广泛用于标示外减肥;加上礼来已经在两项肥胖研究中取得了成功,并可能在年底前被批准作为减肥治疗药物的Mounjaro(tirzepatide,替西帕肽),目前,这些大热的标榜减肥的产品都是注射剂。
无独有偶,5月22日,辉瑞在医学杂志JAMA Network Open发布了在研口服胰高血糖素样肽1(GLP-1)受体激动剂danuglipron的Ⅱb期临床试验结果。试验结果显示,在2型糖尿病患者中,danuglipron显著降低患者的糖化血红蛋白(HbA1c)、空腹血糖水平和体重。通过对411名患有2型糖尿病的成年人进行的临床研究发现,服用120毫克danuglipron的患者在16周内体重减轻了约10磅。相比之下,诺和诺德的Ozempic和Wegovy的Ⅲ期临床试验结果显示,接受1毫克注射剂的成人在30周内平均减重约9.9磅。结果表明,在更短的时间内,danuglipron可能与Ozempic的减重疗效相当。当日辉瑞的股价上涨了4%以上。
同日,礼来在clinicaltrials.gov网站上登记了一项Ⅲ期临床试验(ATTAIN-1),旨在评估每日1次口服Orforglipron(LY3502970)用于治疗伴有体重相关合并症的成人肥胖或超重患者的疗效和安全性。该药公布于EASD2022年会上的Ⅰ期临床结果显示,LY3502970组患者糖化血红蛋白水平(HbA1c)降幅1.5%~1.8%(安慰剂组降幅0.4%),减重1.6~5kg(安慰剂组体重增加0.5kg)。

编辑:陈丽娜
首发于《医药经济报》总第4496期

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-07
2025-05-07
 28
28

 产业资讯
产业资讯
 研发客
研发客  2025-05-07
2025-05-07
 29
29

 产业资讯
产业资讯
 药渡
药渡  2025-05-07
2025-05-07
 29
29