 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2023-07-13
2023-07-13
 3395
3395


2022 年5月20日,美国国会众议院能源与商务委员会(Energy and Commerce Committee,E&C)的3名共和党成员致美国食品药品监督管理局(Food and Drug Administration ,FDA)和政府问责局(Government Accountability Office ,GAO)的两封信,再次引用2016 年澳大利亚新闻记者在《英国医学杂志》(British Medical Journal ,BMJ)上发表的文章中提到的“80% of China’s clinical trial data are fraudulent”[1],来质疑中国现阶段临床试验的数据质量。而实际上,此文章对当年的真相存在误读,也未曾探究整个事件背后特定历史环境下的原因。
当前,中国正处于从医药制造大国向医药创新强国迈进的重要历史节点,开展包括中国在内的国际多中心的临床试验逐渐成为国内外企业进行药品多国注册上市的战略选择。如果不对上述问题进行澄清,国际药品监管部门、学术界、产业界和投资界将可能继续对我国临床试验机构能力、药品监管机构水平持有怀疑态度,将严重降低我国药品质量信誉,一定程度上将阻碍我国药品国际化进程。
1 2015 年自查核查情况
2015 年7 月22 日,原国家食品药品监督管理总局(以下简称“原食药总局”)发布了《关于开展药物临床试验数据自查核查工作的公告》(2015 年第117 号,以下简称117 号文),组织对已申报生产或进口的待审药品开展临床试验数据核查工作,对核查中发现临床试验数据真实性存在问题的相关责任人依法严肃处理。以此拉开中国落实“四个最严”的药品监管改革序幕,“7.22 核查”对中国药品监管改革与医药创新发展都具有里程碑意义。
1.1 药物临床试验数据自查及撤回情况
根据2017 年发布的《药物临床试验数据核查阶段性报告》(以下称“报告”),原食药总局自2015 年7 月先后发布临床数据自查核查通知7 个,共涉及2 033 个已申报生产或进口的待审药品注册申请开展药物临床试验数据核查。其中数量最多(1 622 个)、撤回比例最高(1 210,占比74.6%)且引发社会广泛关注的是2015 年第117 号文所列待查产品(2016 至2017 年发布的6 项公告数量总计411个,撤回106 项,占比25.8%)。
对117 号文所涉及产品整理分析发现,1 210 个产品撤回注册申请,其中905 个产品受理文号被公示(第1 批撤回文号未公示),而公示产品中780 个产品是化学药(表1)。经对撤回申报的药品种类进一步分析发现,其中属于2007 版《药品注册管理办法》化药1.1 类(未在国内外上市销售的药品,通过合成或者半合成的方法制得的原料药及其制剂)撤回的占比仅约1.15%;而化药3 类(已在国外上市销售但尚未在国内上市销售的药品)、6 类(己有国家药品标准的原料药或者制剂)撤回的受理号则分别占化学药分类的37.82%和40.77%(表2),合计78.59%。按照现行药品注册分类都属于“仿制药”的分类。
1.2 药物临床试验数据核查结果
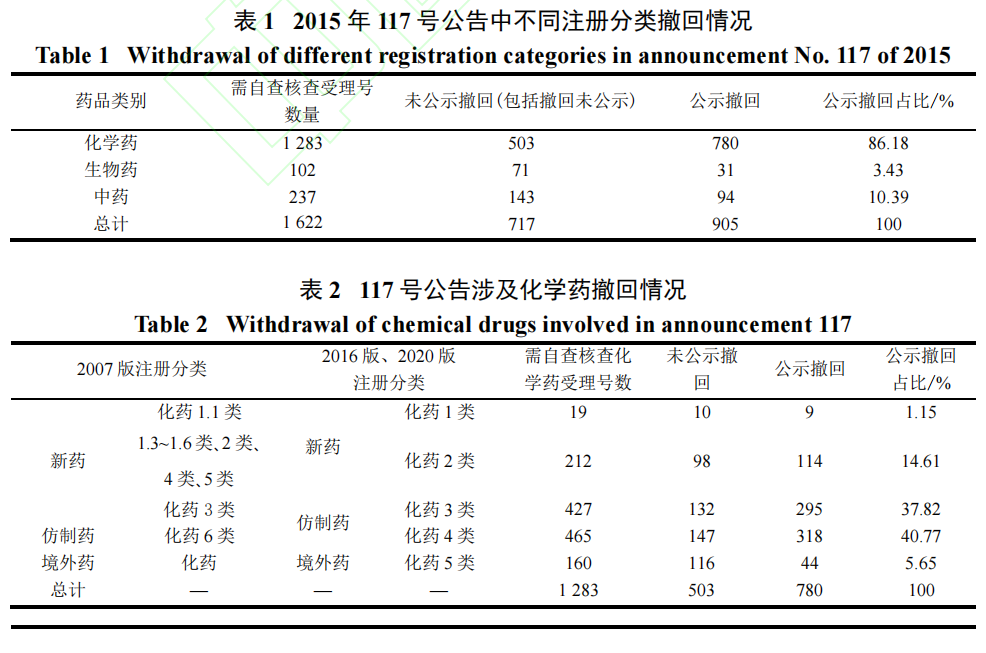
报告显示,2033 项待审注册申请中,最终提交自查资料并进行了临床试验数据现场核查的注册申请共313 个,仅占总注册申请量的15.40%,另有146 个申请待核查,两者共计占比22.58%(图1 )。
根据报告数据及2015 年11 月发布的《药物临床试验数据现场核查要点》,已核查的313 个药品注册申请中出现问题最多的条款是“2.3 临床试验过程记录及临床检查、化验等数据的溯源”,其次是病例报告表(case report form ,CRF)记录问题、用药管理及记录等情形,多为“不规范、不完整”情况(表3)。

从核查结果来看,“有38 个注册申请的临床试验数据涉嫌数据造假”,即可能存在“不真实”问题的注册申请在已核查的产品中占比12.1%[2],其余87.9%产品不存在真实性问题。
截至2017 年6 月,30 个注册申请(全部为117 号文公告涉及受理号)被拒绝批准,数据存在真实性问题的11 个临床试验机构及合同研究组织(Contract Research Organization ,CRO)被予以立案调查。最终,对涉及临床试验数据存在真实性问题的申请人,国家药监局1 年内不受理其所有药品注册申请,已经受理的不予批准。对临床试验机构,责令所涉及专业限期整改,整改完成后要求其委托第三方机构审查评估,并向国家药监局提出申请,检查通过后才能恢复临床试验资格。在国家药监局对申请人、药物临床试验机构、合同研究组织作出处罚决定时还一并向社会公布名单信息,并将其列入黑名单[3]。
1.3 “80% 数据造假”并非事实
“80%数据造假”来自BMJ 文章标题“80% of China’s clinical trial data are fraudulent”,并未说明事实情况。2015 年自查核查,可区分为由申办方、临床研究机构、CRO 等自行发起的“自查”与监管机构就自查后继续申报的注册申请发起的“核查”两项工作。两项工作同步开展近2 年时间,期间分批公布相关情况共发布27个公告。BMJ文章中所提及的“80%”,引用自2016 年9 月新闻媒体对117 号文所涉产品“自查”后“八成”撤回情况的描述。“自查”阶段申请人主动撤回的行为不能全部视为同一情况,更不能被定性为“核查”阶段才可认定的“造假”[4]。在对未撤回产品实施“核查”工作中,虽然发现诸多质量问题,但大规模撤回的临床试验数据主要问题在于“不规范、不完整”,最终可能存在“不真实”的产品仅为12.1%,并非“80%”。
2 自查核查原因分析
自查核查事件所发现的问题不能简单地归责于企业和临床试验机构,还要考虑其所处时期的特殊性。监管质量与产业发展相辅相成,当申办者出现大规模提交不规范、不完整的数据,甚至出现不真实行为时,需要认真思考发生上述问题的原因及监管体系是否有不合理及不完善的情形。
2.1 药品管理分类标准缺乏科学理念
创新药与仿制药的差异在于两者追求不同的研发目标,采用不同的验证方案证明其符合上市标准,因而国际上通行对创新药与仿制药区分管理,要求两者使用不同申报资料申报上市。创新药以临床价值为导向,最终需解决未被满足的临床需求,因而需开展临床试验以证明其安全有效并使患者获益。仿制药则以物质成分为标准,需证明其与已上市参照药物具有一致性,一般需开展生物等效性和疗效一致性研究。在监管方确认申报标准后,企业可依据注册分类标准及分类要求确定产品所属分类和应采用的研发内容,进而开展相应研究申报上市。
2008年以前,我国的新药定义为首次在中国上市的药品,因而仿制境外已上市境内未上市药物(2007版化药3类)也按新药管理并要求开展临床试验,实际上是在国内重复境外已有的药物有效性及安全性研究。同一时期,仿制境内已上市药物(2007版化药6类)上市要求为与国内已上市同通用名产品进行对比,而不是与原研药做比较,无需开展一致性评价,使上市仿制药产品质量参差不齐,仿制标准不断降低。
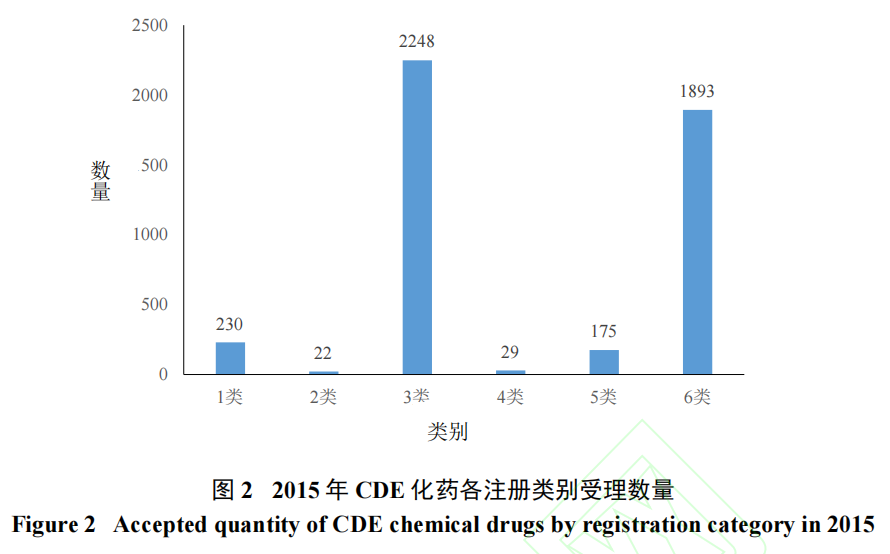
分类标准不合理、参比制剂政策不成熟等多种因素导致在我国开展仿制药研发具有“捷径”,大量企业扎堆申报2007版化药3类药和6类药。2015年,药品审评中心(Centre for Drug Evaluation,CDE)待审注册申报累计量为21 783件[5],达2010年以来的峰值,2007版化药3类和6类积压最为严重[6](图2)。
整体而言,当时的药品注册申请积压及撤回现象是由化学仿制药注册分类不合理所引发的阶段性问题,与现在的“创新药”基本不存在关联。
2.2 药品研发监管重审批轻管理
良好、全面的管理应依托完善的监管法规、合理规范的管理体系并辅以高效的管理工具。但2015 年之前,我国监管机构持续以“行政审批”为重要手段的进行强监管,缺乏科学管理机制的构建[7],严重降低了中国新药研发效率。2015 年使用的2003 版《药品临床试验管理规范》(Good Clinical Practice ,GCP)主要关注加强临床试验的批准权,其特点是“严进宽出”,监管理念与国际人用药品注册技术协会(The International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use ,ICH)相反。2003 版GCP 不仅要求新药从Ⅰ期到Ⅲ期每一阶段临床试验必须在取得药监局书面同意后进行,还要求其必须在药监局和卫生部批准的药物临床试验机构开展。而同样在审批约束下,2015 年中国具有临床试验资质机构仅有440 家[8],临床试验在排队获批后仅能在有限的机构中开展,缺少筛选机构的机会;药物临床试验机构则承担了超出自身管理能力的临床试验任务。根据2015 年第172 号公告,在生物等效性(bioequivalence ,BE)试验和Ⅰ期临床试验中,公告涉及的82 家临床试验机构,共承担622 项试验;在Ⅱ期、Ⅲ期临床试验中,则共有383 家单位承担5 635 项临床试验。
另一方面,临床试验管理的权责不清,也成为了“722”事件爆发的推手之一。由于监管准入事前审批门槛较多,申办企业和研究机构易认为药品监管部门已经承担绝大部分药品监管责任,忽视了其自身在临床试验过程中的职责,放松了试验过程中的管理,将工作重心放置于排队申请试验及文号。
而作为兜底的注册核查方面,按2007 年版《药品注册管理办法》规定,药品注册上市申请的临床试验核查由受理所在地省局实施,受各地区人力资源及核查经验的限制,地方药品审核部门面临审查速度与审查质量不能兼顾的问题,难以起到最终把关临床试验质量的作用[9]。
此外,在管理工具使用上,当时临床试验的数据大多基于CRF 的数据采集结果,电子化数据采集与数据管理系统应用还未推广和普及。药物临床试验数据管理在规范化程度及质量上均良莠不齐,数据质量也难以管控。
2.3 政策改革导致问题暴露
从2015 年下半年至2016 年上半年,国家启动药品审评审批制度改革,监管政策文件密集出台。文件中既有代表思想改革的政策引导性文件如《国务院关于改革药品医疗器械审评审批制度的意见》(44 号文),也有填补监管空白的执行性文件如《药物临床试验数据现场核查要点》,更不乏多项指导临床试验数据管理文件如《临床试验数据管理工作技术指南》、《临床试验的电子数据采集技术指导原则》和《药物临床试验数据管理与统计分析的计划和报告指导原则》等。
一系列政策举措带来了产业风气焕然一新的改革成果,也不可避免的对行业运行带来了改革阵痛。我国2015 年之前相关法规中未对临床试验的数据质量及核查标准做出详细要求,临床试验执行中同样缺乏参考要点。在《关于开展药物临床试验数据自查核查工作的公告》(117 号文)发布后,审评审批方式和依据快速转变并迅速完善。对于已完成研究并申报的企业而言,如已有研究质量不符合现行标准将面临严厉惩罚,因而企业自查后主动撤回申请也是无奈选择。
3 2015 年药品监管改革成效
3.1 变革药品注册分类,提高药品审评标准
2015 年8 月,《国务院关于改革药品医疗器械审评审批制度的意见》(44 号文)将“新药”定义修改为“未在中国境内外上市销售的药品”,即“全球新”。2016 年3 月,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》(国办发[2016]8 号)要求对已上市仿制药按照与原研药品质量和疗效一致性进行评价。药品注册分类和审评标准的改变显著提升了申报门槛,系统性扭转了临床试验质量问题所根植的制度环境。2007 版化药3 类注册申请自2015 年起产生了申报低谷,企业改变策略不再开展重复性研究,而在原研药上市后按照2016 版注册分类化药4 类仿制药申报[10]。
3.2 建立基于风险和社会共治的临床试验管理体系
3.2.1 将临床试验管理责任落实到试验相关方
2017 年10 月中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[11]进一步推进改革,对临床试验机构资格认定实行备案管理。截至2022 年7 月,全国备案药物临床试验机构已达1 223 家[12],且临床试验机构、主要研究者资质和条件较以往均有提升。2019 年新修订《药品管理法》将临床试验默示许可制度正式纳入法律轨道[13]。制度明确了临床研究利益相关方责任,也改变了临床试验审批时间严重制约药品审批效率的困境。2021 年,我国药品临床试验登记数量达3358 项,其中新药临床试验2033 项,占比60.5%[14],研发结构与2015 年截然不同。2020 年新版GCP 再次明确了伦理委员会、申办方、研究者和药品监督管理部门在药物临床试验质量管理中的责任,进一步巩固相关方责任意识。
3.2.2 风险管理常态化
国家药品监督管理局食品药品审核查验中心持续关注核查体系建设,2021 年发布《药品注册核查工作程序(试行)》等5 个文件,进一步完善核查要求。临床试验药品注册核查的启动经“基于审评需要启动”过渡发展为当前的“基于风险启动”,常态化的核查工作可以切实控制临床试验过程中的风险,保障临床试验质量。同时,药物临床试验数据核查的开展程序则改为由药品审评中心向核查中心发出临床试验数据核查任务,药品核查中心完成核查后将核查报告返回药品审评中心,合理分工既保障了审评时限的整体控制又保障了对数据真实性及可靠性的重点核查。
3.2.2 风险管理常态化
国家药品监督管理局食品药品审核查验中心持续关注核查体系建设,2021 年发布《药品注册核查工作程序(试行)》等5 个文件,进一步完善核查要求。临床试验药品注册核查的启动经“基于审评需要启动”过渡发展为当前的“基于风险启动”,常态化的核查工作可以切实控制临床试验过程中的风险,保障临床试验质量。同时,药物临床试验数据核查的开展程序则改为由药品审评中心向核查中心发出临床试验数据核查任务,药品核查中心完成核查后将核查报告返回药品审评中心,合理分工既保障了审评时限的整体控制又保障了对数据真实性及可靠性的重点核查。
3.2.3 临床试验数据不真实行为入刑
制度环境的转变和药品质量的提升使监督管理部门对临床试验管理的监管思路发生了质的改变。2017 年4 月,最高人民法院、最高人民检察院联合发布《关于办理药品医疗器械注册申请数据造假刑事案件适用法律若干问题的解释》[15]以完善临床试验数据的法律责任体系,故意提供虚假的药物非临床研究报告、药物临床试验报告及相关材料的,将被认定为刑法第229 条规定的“故意提供虚假证明文件”。2019 年某CRO 员工伪造文件用于加速临床试验项目流程,最终被判处有期徒刑2 年,缓刑2 年,为业内再次敲响警钟。
3.3 加入ICH 与国际接轨,完善监管标准及指导原则
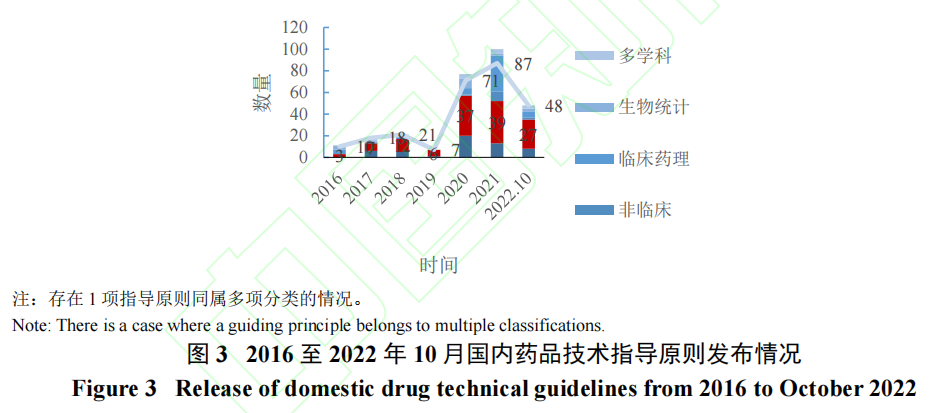
2017 年6 月,原国家食品药品监督管理总局以成员身份加入ICH,积极推进ICH 指导原则落实转化,以国际标准来指导我国药品研制行为。据CDE 统计显示截至2022 年5 月,63 个ICH 指导原则中已发布公告明确实施时间点的共有59 个,已实施55 个,转化率高达93%[16]。进入“十四五”后,在吸收ICH 指导原则下,药品监管部门也大幅加快了我国指导原则体系建设的节奏,仅2021 年,药品审评中心就已完成制定87 个指导原则,并明确未来五年内完成480 项指南的工作目标[17]。大量指导原则的建立使临床试验的每一环节都有参考依据:对药审中心官网发布的指导原则进行梳理(图3),发现在临床试验管理方面,自2016 年起已有共131 个指导原则正式发布,内容涵盖研发导向、研究方法、试验设计、文件撰写 等多个环节[18];而在辅助临床试验管理方面,如生物统计,指导原则也对统计分析、数据监察等领域进行了详细规定。
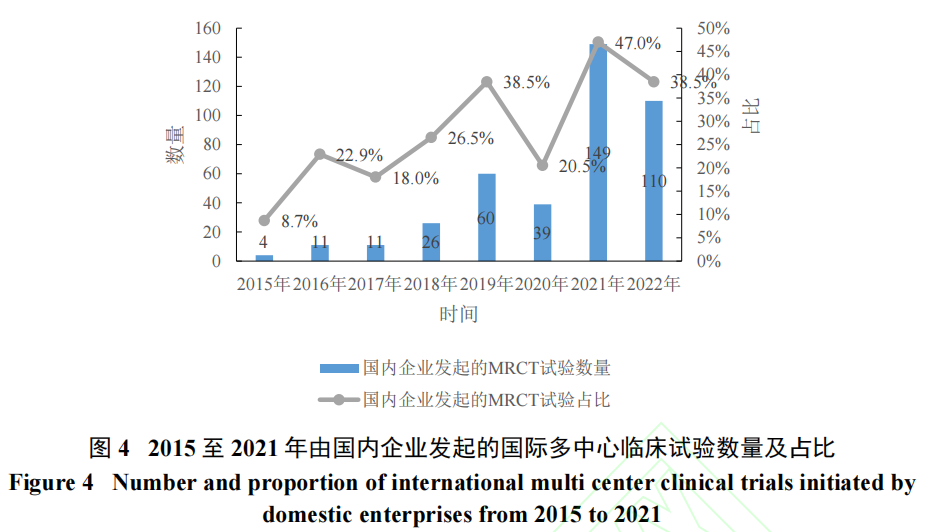
与国际的高度接轨一是对于申办方规范完成药品研发及注册具有重要作用,二是可以提高我国企业竞争动力,为我国药品全球同步研发和注册提供了先决条件。据弗若斯特沙利文及笔者统计,近年来我国企业开展的接受国际标准监管的国际多中心临床试验规模不断提升(图4)。
3.4 改革后临床试验数据核查不通过率大幅降低
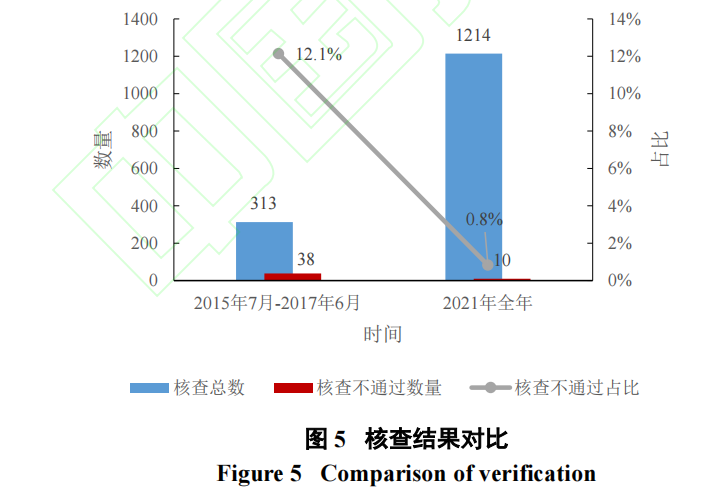
在一系列改革下,我国临床试验质量有了显著提升。《2021 年度药品检查工作报告》和《2021 年度药品审评报告》显示,2021 年我国共开展药物临床试验现场核查任务383 件(未单独说明核查结果),同期共完成药品注册核查任务1214 个,核查不通过的任务共10 个,占比仅为0.8%[19]。分析药品检查工作报告中药品注册核查存在的主要问题,未见出现临床试验数据不真实情况。对比2015 年7 月至2017 年6 月所开展的临床试验数据核查结果,核查不通过率已降低15 倍(图5)。
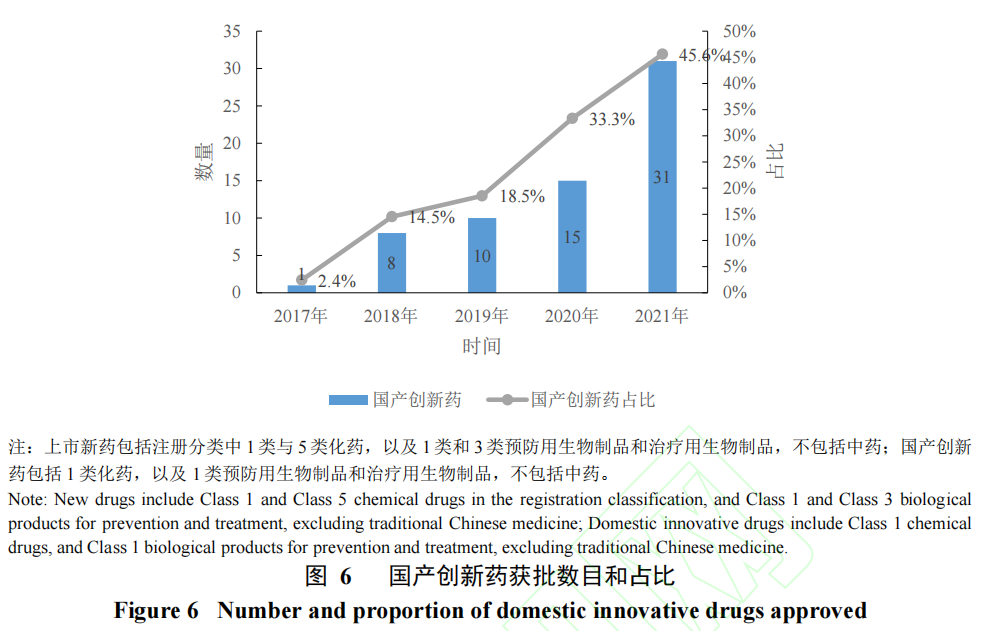
此外,据FDA 药品境外检查工作统计数据,2015 至2021年FDA 对我国进行生物研究检查(Bioresearch Monitoring ,BIMO)25 次[20],检查结果为全部合格;在近年FDA 对境外进行的生产质量的检查中,中国占比约16%,合格率约90%[21]。从产业创新能力提升情况来看,据药智数据库统计显示,由我国企业自主研发的创新药物获批数目、占上市新药数目比例逐年增高(图6)。临床试验质量和企业创新能力的双提升,对外授权数目日益增高,中国医药创新能力得到了全球认可。
4 建议
面对新时代新环境,我国仍需继续解放思想、完善产业制度建设、持续推动创新发展。
对于管理理念,监管方应发挥管理、服务和引导职能。首先可根据产业发展趋势强化以临床为导向的创新药品分类标准,进一步细化优先审评标准,按产品创新程度设置差异化管理及审评模式,优化审评资源分配,支持解决未满足临床需求的药品或首创药品上市。其次需根据产业需求出台相应指导原则,通过体系性的指导原则与个性化的沟通交流在临床试验启动前给予申办方和研究者参考依据。最后,针对临床试验水平仍有较大优化空间的现实情况,应鼓励申办方与临床研究者不断提升临床试验设计与执行能力,注重临床试验方案的可操作性,关注国际监管要求变化趋势,以科学合理的标准制定研究计划。
对于管理机制,应充分利用科学工具并加强公开力度。面对日益复杂化的临床试验管理,一是可使用智慧监管工具提高监管效率和质量。我国药品监督管理部门可依托我国数字网络发展优势联合相关机构加强电子病历体系建设,要求机构与药监系统建立数据直输系统,实时向监管部门提交患者病历等研究数据。二是药品监督部门应当每年对外公布药品临床试验核查报告,以公开透明的方式展示我国药物临床试验的成果,指出工作中出现的不足和问题。通过管理机制建设,确保临床试验原始数据和记录真实、准确、完整和可追溯,最终建立领先世界的管理体系,形成行业声誉,为我国药品出海打下坚实基础。
对于法律威慑,还需持续强化临床研究利益相关方责任意识,严格落实惩处措施。在试验完成时,既要通过严格的核查发现问题,也要通过严肃的处理惩前毖后。对于有主观不真实行为的机构应当依法严厉处罚直至追究刑事责任并取消其备案资质。对于故意有主观不真实行为的研究者,应将其纳入黑名单。
问题长期积压常会导致短期的快速改革,对产业造成极大挑战。政策制定方需关注产业发展趋势,保持国际化视野和自我革新的精神,在问题发现早期即采取积极的前瞻性政策进行引导。产业各方也应承担相关义务:申办方应建立临床试验质量管理体系对临床试验及第三方合同组织开展有效管理,研究者应与申办方共同确定试验设计方案的合理性和适用性,而伦理委员会也应承担审查职能严格把关。监管方与产业相关方应保持密切的联系,以国家和人民需求为导向,以创新发展为目标共同解决产业问题。
参考文献:
[1]Woodhead M. 80% of China’s clinical trial data are fraudulent, investigation finds[EB/OL]. (2016-10-05)[2022-08-01]. https://www.bmj.com/content/355/bmj.i5396.
[2]国家药品审核查验中心. 药物临床试验数据核查阶段性报告(2015 年7月至2017 年6月)[EB/OL]. (2017-07-21)[2022-08-01]. https://www.cfdi.org.cn/resource/news/9137.html.
[3]国家药品监督管理局. 总局关于药物临床试验数据核查有关问题处理意见的公告(2017 年 第 63 号)[EB/OL]. (2017-05-24)[2022- 10- 18].
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20170524175101139.html.
[4]央视网. 八成新药临床数据被指涉假 食药总局回应[EB/OL]. (2016- 10-25)[2022- 10- 18].
http://jiankang.cctv.com/2016/10/25/ARTIAPgdqsE2qq8ddrbivUKM161025.shtml.
[5]陈新, 黄清竹, 温宝书. 药品审评中心解决化学仿制药注册申请积压工作汇总及分析[J]. 中 国新药杂志, 2017, 26(18): 2136-2142.
[6]李小欢, 徐昕玥, 杜爽, 等. 化学药品注册改革对我国医药行业的影响研究[J]. 中国药师, 2017, 20(2): 324-326.
[7]臧克承. 我国药品检查规制刍议[J]. 中国食品药品监管, 2018, (5): 17-21.
[8]中国医药创新促进会. 《构建中国医药创新生态系统:系列报告第四篇:推进创新药同步研 发、注册与审评》正式发布[EB/OL]. (2021-09- 13)[2022-08-01].
http://www.phirda.com/artilce_25403.html.
[9]何辉, 杨兰, 高磊, 等. 新形势下药品注册核查启动工作的实践和探索[J]. 中国临床药理学 杂志, 2022,38(11): 135- 138.
[10]研发客. 3 类化药研发将重焕生机 第一现场[EB/OL]. (2021-02-05)[2022-08-01]. https://mp.weixin.qq.com/s/qUS0RbHw0JAk-0x5yx75VA.
[11]中共中央办公厅. 国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创 新的意见》[EB/OL]. (2017- 10-08)[2022- 10- 18]. http://www.gov.cn/zhengce/2017-10/08/content_5230105.htm.
[12]药物临床试验机构备案管理信息平台. 临床试验机构备案信息[EB/OL]. [2022- 10- 18]. https://beian.cfdi.org.cn/CTMDS/apps/pub/drugPublic.jsp.
[13]吴旖婷, 朱芒. 药物临床试验默示许可制度探究[J]. 中国食品药品监管, 2020, (3): 31-37.
[14]国家药监局药审中心. 国家药监局药审中心发布《中国新药注册临床试验进展年度报告 (2021 年)》[EB/OL]. (2022-06-07)[2022-08-01].
https://www.cde.org.cn/main/news/viewInfoCommon/1839a2c931e1ed43eb4cc7049e189cb0.
[15]最高人民法院. 最高人民法院最高人民检察院关于办理药品、医疗器械注册申请材料造 假刑事案件适用法律若干问题的解释[EB/OL]. (2017-08- 14)[2022-08-01].
https://www.court.gov.cn/zixun-xiangqing-55952.html.
[16]沙明泉, 张亚伟, 周红洁, 等. 我国药品技术指导原则体系建设回顾与展望[J/OL]. 中国药 物警戒, 2022, (10): 1-6. http://kns.cnki.net/kcms/detail/11.5219.r.20220805. 1403.002.html.
[17]国家药品监督管理局. “十四五” 国家药品安全及促进高质量发展规划[EB/OL]. (2021- 12-30)[2022-08-01].
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjzh/20211230192314164.html.
[18]国家药品审评中心. 国内药品技术指导原则[EB/OL]. [2022-08-
01].https://www.cde.org.cn/zdyz/listpage/9cd8db3b7530c6fa0c86485e563f93c7.
[19]国家药监局核查中心. 国家药监局核查中心 2021 年度药品检查工作报告[EB/OL]. (2022-06-26)[2022-08-01]. https://www.cfdi.org.cn/resource/news/14698.html.
[20]FDA. Inspection Classification Database[EB/OL]. (2021- 12- 16)[2022-08-01].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection- classification-database.
[21]国家药品审查查验中心. 国际药品检查动态研究[EB/OL]. (2020-04-20)[2022-08-01]. https://www.cfdi.org.cn/resource/news/12183.html.

 产业资讯
产业资讯
 研发客
研发客  2025-06-26
2025-06-26
 33
33

 产业资讯
产业资讯
 医曜
医曜  2025-06-26
2025-06-26
 33
33

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-06-26
2025-06-26
 32
32