 产业资讯
产业资讯
 同写意
同写意  2023-08-17
2023-08-17
 2904
2904
应同写意邀请,中山大学药学院经济研究所所长宣建伟在“首届广州国际生物医药产业大会”上做了关于《创新药的全方位准入、支持和可持续发展》报告,本文系根据报告内容整理。

宣建伟 中山大学药学院经济研究所所长
如今的本土创新药商业化之旅,似乎还有一段很长的路要走。
在整个创新药商业化的过程中,大家都面临着非常多且严峻的挑战,“中国创新药商业化很少能实现盈利”就是大多本土企业首要考虑的问题。而从中国政策法规、支付体系逻辑出发,面对这种现象,我们应该如何去面对?成功的创新药商业化之路,到底还有哪些关键的因素?
1 价值评估在市场准入中的重要性

过往十年,我国创新药商业化的政策环境一直在不断优化,药监局政策利好,使我国创新药高速发展。2013年,中国新药领域的投融资,就取得突破性增长。随后三年,我国本土创新药和创新企业的数量不断扩增,获批新药、新药NDA也呈现井喷式增长。
从2017年部分药品批准上市后8年才进入医保目录,到去年22款创新药在上市当年即通过谈判进入医保目录,医保药品目录调整周期缩短,极大加快创新药从上市到进入医保的速度。2017-2020年,医保谈判品种的销售额都有大幅度明显增长,极大地鼓励了企业的创新积极性,也切实保障了患者的用药需求和新药、好药的可及性。
量变引起质变,在国家拉动医药板块的同时,市场也在向合理用药方向积极得变动,国家卫健委《药品临床综合评价管理指南》确立的评价维度,就是提高临床合理用药的重要技术工具。
从产品端来看,由专家评估主导的医保药品目录调整申报,正逐步向证据数量及质量主导方向发展。从市场决策端来看,2019年,创新药正式进入医保谈判予以报销,增加了其竞争中国医药市场份额的机会。紧接着,2021年,卫健委出台《医保管理机制指导意见》,将所有纳入医保的药品恒定6个评估维度,即安全、有效、经济、创新、适宜、可及。
总结来说,影响创新药商业化的成功,并不是单一因素,做创新药研究的企业要从多维度综合价值证据支持产品定位以及进行多层次商业布局。主要从四个方面评判:
1.根据真实世界临床研究数据及医保评估证据和结论得出,该药是否具有临床创新性、能否满足未满足的临床需求,能否提高疗效、降低不良反应的临床价值;
2.根据疾病负担成本效益经济模型,基金冲击影响模型,评估该药品的性价比、医保基金纳入该药品的承受能力的经济价值;
3.根据真实世界用药依从性、病人为中心的QOL研究,能否改善病人临床症状,进一步提高病人生命质量,适应病人具体使用的病人价值;
4.根据真实世界临床研究数据及社会流行病学研究,是否会对社会带来创新的社会价值。
药监局审批政策宽松,大量药企跟进热门靶点进行研发,在同质化竞争激烈的大背景下,“红海泛舟”的不止PD-1,大量靶点可能重蹈覆辙。医保目录准入常态化降价,也对企业投资回报和创新动力带来双重压力。随着医保局、卫健委多项政策的落地,医院、医生层面的准入面临更高要求和挑战。
当下,企业要想实现药品的全面准入,唯有广泛布局,需要准备涉及多维度的战略策略,保证有价值的沟通证据及创新合作方法,真实做到全方位的医保准入,医院准入,医生准入,及病人准入才有希望做到创新药商业化的成功。
2 全面市场准入及可持续性发展
各国医保的钱都是有限的,不可能无限制吸纳所有创新药。并且,随着医保谈判药品落地,可以观察到,市面上的罕见病用药、突破性用药、可治愈性用药,现在在中国的准入都有相应的问题,不确定因素很多。可以说,创新药品全面市场准入,还面临诸多挑战。
首先,随着我国社会人口老龄化,慢性病、重大疾病的医疗保障问题及其相关机制的完善需要医保部门持续关注。尤其在医保药品目录规律性的每年调整一次,此后基金收入增速低于支出增速将成为新常态,这对于医疗保障基金中长期平衡存在一定压力。
其次,医保谈判药品“落地难”。部分创新药品缺乏足够的时间进行临床使用经验积累、获得临床专家认可到广泛使用需要时间,同时进医院的周期大幅压缩,对医疗机构的快速准入能力、医保部门相关配套政策的制定和临床医生短期内广泛使用都提出了更高的要求。
然后,罕见病用药、有治愈功能的创新药等不断更新,疗效显著但价格高昂。如何在保证突破性创新药、“救命药”可及性的同时鼓励创新、保证企业的可持续发展,这对医保战略性购买及谈判议价能力都提出了挑战。
最后,药企应该考虑收集长期的真实世界疗效数据作为参数支持,医保可考虑对此类药品进行以价值为基础的定价,其阈值的设定、支付标准的确定,也都需要进行特殊考虑。
那么在这种大背景下,创新药品的全面准入,还要从两方面入手。
第一,政策的进一步完善。首先,综合评审过程中对其创新性与安全性、有效性的相对权重可考虑进行调整并突出其贡献;其次,在价值评估过程中,对于ICER阈值和预算影响分析的结果应该有所区分,对源头创新产品,相对于仿制创新,可考虑给予差异化的阈值设定和和预算影响范围设定,对应药监局有条件批准的药品可以尝试有条件支付方法。
同时,药物经济学评估方法学也要从参照品、模型选择、成本参数、疗效参数、情景分析等方面入手,不断优化、进一步完善价值评估的方法学。
第二,打铁还得自身硬,企业需要产生多维度证据支持,进而鼓励真实世界研究,降低临床证据的不确定性。对药品进行全生命周期管理,以支持其战略布局与商业化成功。
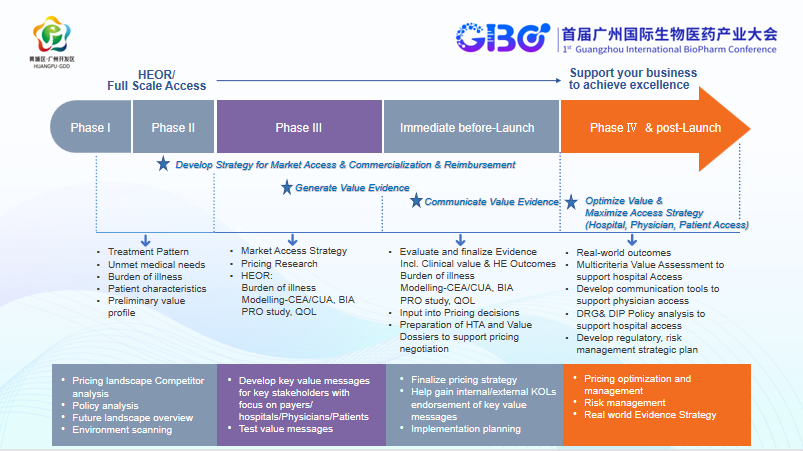
我们一直在讲商业化,一个成功的商业化产品,应该具备哪些必要条件?我总结了四个必要条件:
1.注重综合价值的产生。具有强有力的多维度价值证据包括临床,经济,病人,及社会价值以支持医保、医院、医生及病人的全面准入。
2.具有以价值证据为基础的强大商业化沟通能力。在对一款创新药了解还不够多的时候,临床处方往往非常谨慎、不会轻易接受。这时,就需要有专业的商业沟通团队,将证据结果有效地传递给医生及病人,达到医患群体的教育促使处方行为习惯改变。
3.要注重对药品全生命周期的投入而不是上市后即停止或减少相关临床价值证据的研究。强有力的价值证据大都产自大样本的临床研究、真实世界研究,而适应症的拓展、产品的国际化也都需要大量的资源投入。
4.上市后研究的重要性。例如,辉瑞的立普妥,该药是医药史上第一个“超级重磅炸弹”,立普妥完成了同靶点后上市的后来者到医药史上最畅销药物的飞跃。正是该药不断进行的上市后再研究,临床就达400多项,覆盖80000多位患者,其中最为重要的即为初级预防即二级预防大规模真实世界研究。这些研究除了显示立普妥优于竞品之外,还观察到了心血管疾病、糖尿病等超适应症患者的获益。为立普妥的商业成功奠定了多维度价值证据基础。

 产业资讯
产业资讯
 医药财经
医药财经  2025-06-12
2025-06-12
 57
57

 产业资讯
产业资讯
 细胞与基因治疗领域
细胞与基因治疗领域  2025-06-12
2025-06-12
 56
56

 产业资讯
产业资讯
 医曜
医曜  2025-06-12
2025-06-12
 60
60