 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2023-08-21
2023-08-21
 3337
3337
8月14日,临床阶段基因治疗公司Taysha Gene Therapies宣布完成约1.5亿美元私募融资。本轮融资由新投资者RA Capital Management领投,PBM Capital、RTW Investments、LP等跟投。
Taysha总裁兼CEO Sean P. Nolan表示:“本轮融资收益加上我们现有的现金和现金等价物,将延长公司现金跑道至2025年第三季度,主要用于支持治疗Rett综合征(一种严重影响儿童精神运动发育的疾病)的TSHA-102项目的临床开发,以及治疗巨轴索神经病(GAN)的TSHA-120项目活动等。”
同日,Taysha报告了首例成年rett综合征患者在I/II期临床试验中的积极的初步临床数据,并提供了公司2023年第二季度财务业绩的最新数据。受这些消息影响,当天Taysha股价大涨188%,市值达1.37亿美元。
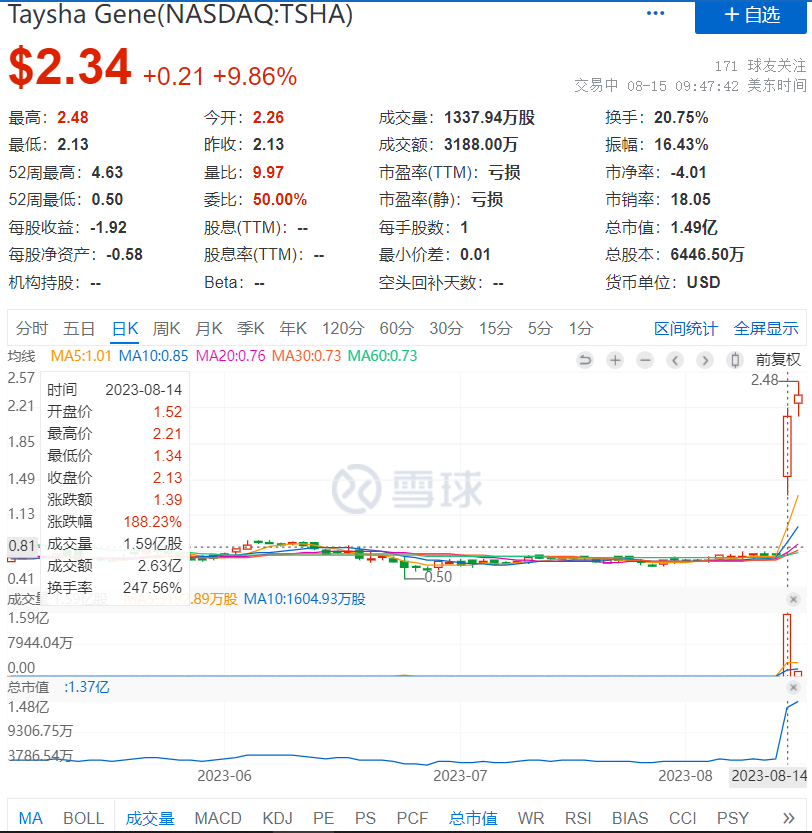
来源:雪球
Taysha总部位于美国德克萨斯州达拉斯市,专注于开发和商业化基于AAV的基因疗法,用于治疗中枢神经系统(CNS)的单基因疾病。公司与德克萨斯大学西南医学中心合作,建立了一个广泛的AAV基因治疗管线,重点关注罕见病以及大适应症市场。该公司于2020年9月24日在纳斯达克上市。
Taysha以腺病毒载体为研发核心,联合基因替代治疗、微小RNA(miRNA)和发卡RNA(shRNA)疗法,推出采用鞘内注射方式的十几款基因治疗药物,布局了3大类(神经性退行疾病、神经发育障碍疾病、遗传性癫痫)广泛神经适应症。
TSHA-102是一种在研中用于治疗Rett综合征的自我互补鞘内给药AAV9基因替代疗法。TSHA-102利用创新miRNA响应性自调节元件(miRARE)平台,调节基于单细胞的基因型转基因表达。miRARE技术旨在预防转基因过度表达相关毒性,可潜在地用于其他适应症。TSHA-102已获得FDA孤儿药和罕见儿科疾病资格认定,以及欧盟委员会孤儿药资格认定。
TSHA-120是一种提供gigaxonin 基因的鞘内给药的AAV9替代疗法,用于治疗巨轴突神经病,目前正在进行II期临床试验评估。TSHA-120已获得FDA孤儿药和罕见儿科疾病资格认定,以及欧盟委员会孤儿药资格认定。
Sean P. Nolan表示:“我们对本季度在两个主要研究项目的临床评估方面取得的进展感到高兴。对于治疗Rett综合征的TSHA-102,我们相信在治疗后四周第一例重症成年患者身上看到的初步安全性和显著的临床改善,增强了我们基因疗法的转化潜力,以从根本上治疗Rett综合征。重要的是,这些早期数据表明,miRARE技术正在逐个细胞的基础上介导中枢神经系统中MECP2基因的表达,支持miRARE的调控。我们将专注于继续探索TSHA-102治疗潜力,第二例患者的给药预计将在今年第三季度进行。
我们还获得了美国FDA的批准,可以在美国儿科患者中启动TSHA-102的临床开发,并已向英国MHRA提交了一份针对Rett综合征儿科患者的TSA-102的CTA,这将把我们的临床评估扩展到疾病进展早期的儿童。
对于治疗GAN的TSA-120,我们利用疾病进展模型(DPM)进行的新的综合数据分析已提交给FDA,计划在今年第三季度与监管机构一起审查TSA-120的潜在调节通路。”

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 104
104

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 93
93

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 81
81