 产业资讯
产业资讯
 医药魔方
医药魔方  2023-08-31
2023-08-31
 3070
3070
“创新”分很多种,并不是只有first-in-class才称得上创新,me better属于分子结构上的创新,差异化适应症布局属于临床开发上的创新,而对剂型的改良也是一种创新。它是一种技术上的突破,同样能够为患者带来别样的临床获益。
抗体药物的出现使创新药研发从小分子时代迈向了一个新的阶段,这类药物不仅为现有药物疗效不佳的患者提供了更优的选择,更是打破了许多疾病无药可治的局面。不过,无论是研发还是生产制造,抗体药物开发的复杂性和成本相较于小分子都大大增加。另外,作为具有活性的生物制剂,抗体药物的使用和携带无法像小分子药物那样便捷,大多只能以静脉注射(IV)的方式在医院用药。这不仅给患者带来很大的不便利性,也给医疗卫生系统增加了负担。
不过,这类药物的给药方式也在悄然发生着变革。自2015年以来,随着FDA批准抗体药物数量的增加,皮下制剂的数量也显著增加。覆盖的疾病领域也逐渐从自免等慢性病向肿瘤领域倾斜。
2017年罗氏利妥昔单抗皮下注射剂获FDA批准上市,成为了首款获批上市的用于治疗恶性肿瘤的皮下注射抗体药物。2021年,康宁杰瑞/思路迪/先声药业联合开发的恩沃利单抗获国家药监局附条件批准上市,用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)晚期实体瘤成人患者治疗。这款药物不仅是中国药企成功开发并获批的首款PD-L1单抗,更是全球首款获批上市的皮下注射(SC)PD-(L)1单抗。昨日,罗氏阿替利珠单抗皮下制剂也在英国获得了批准。
静注型抗体药物药价外的“隐形”负担
通常来说,有效性和安全性是药品监管机构判断一款药物是否有价值并批准其上市的重点评估维度。不过,在具体的临床运用过程中,一款药物的价值评判维度将更多面,除了安全性和有效性外,便利性、经济性、对生活质量的影响等也是非常重要的考量因素。
静脉注射剂虽然已经在临床运用过程中积累了非常成熟的经验,制药企业之所以在其基础上进一步开发皮下制剂,这与其在具体场景中体现的众多未满足的需求有很大关系。
首先,相较于皮下制剂,静脉注射剂的使用会花费患者更长的治疗时间。以曲妥珠抗单抗为例,乳腺癌患者接受传统静脉输注剂型需要每3周到医院治疗1次,每次给药30~90分钟,而其皮下注射剂只需2~5分钟就可以完成治疗,这对于需要长期接受抗HER2治疗的患者来说是截然不同的体验。用于治疗血液瘤和自免疾病的CD20抗体利妥昔单抗IV的输注时间长达2.5小时,而其皮下注射剂仅需5分钟就能完成给药。
相较于SC,患者去医院接受治疗过程更是“一场漫长的等待”。一项横跨八个国家的研究显示[1],在不同国家的非霍奇金淋巴瘤患者中,接受利妥昔单抗IV患者的平均“坐椅时间”(Chair time)为262.1分钟,而SC的平均时间为67.3分钟,减少了74%(p<0.0001)。
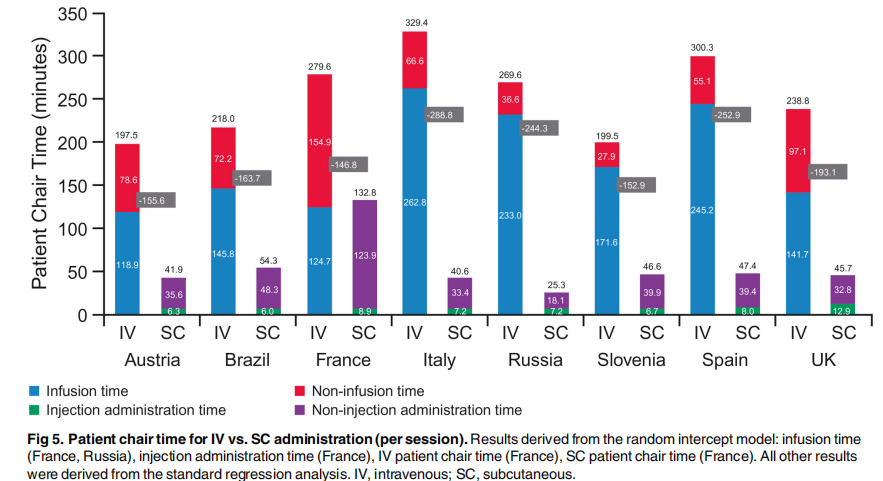
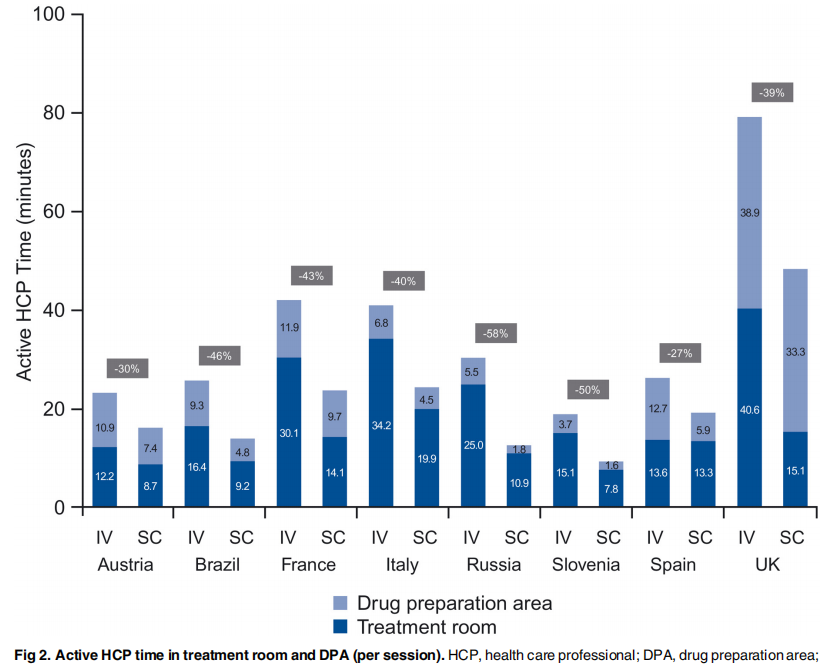
这一差异不仅体现在患者的治疗与等待时间上,也体现在对医务人员的持续占用上。由于IV过程中,医务人员需要安装和断开外置导管(或冲洗永久输液管),同时需要定时对输注过程进行监控,因此在治疗间和配药房(DPA)所花费的时间远远超过SC。这也将进一步加剧医疗资源的紧张。
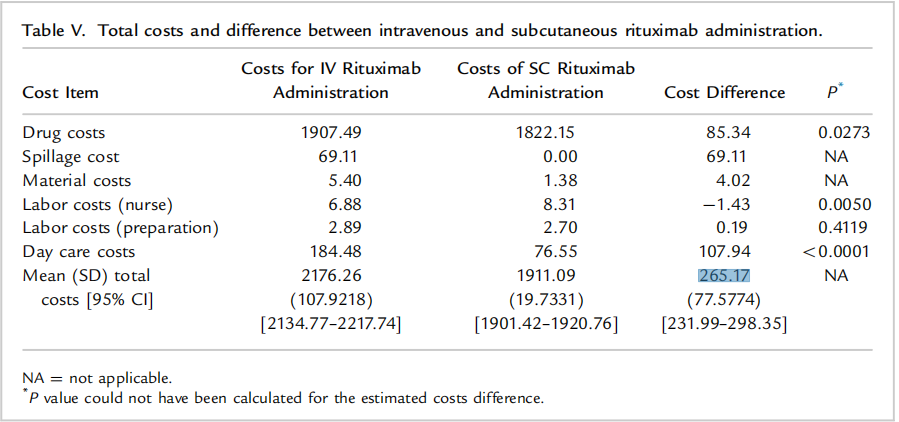
除了时间成本外,相较于SC,患者因去医院接受IV治疗而产生的医疗费用更是一笔巨大的开支。IV需要额外的溶液和输注装置、耗材等,也更容易造成资源的浪费。一项观察性研究表明[2]:利妥昔单抗IV和SC剂型平均每次的治疗费用差异高达265.17欧元(95% CI, €231.99-€298.35)。
抗体药物皮下注射剂的出现不仅能够节约患者和医务人员的时间。与静脉注射剂型相比,有些皮下制剂为固定剂量,不需要根据每个患者的体重每次进行剂量计算,大大方便了患者及医护人员,从而将肿瘤治疗过程对患者生活质量的影响降至最低。一项患者的用药偏好性调查结果显示[3],大多数患者(86%)更偏好于曲妥珠单抗皮下注射治疗。皮下注射剂型也更受医护人员欢迎,医疗专业人员满意度调研中有77%的医生和护士会首选皮下制剂。
肿瘤抗体药皮下剂型开发将成为常态
事实上,将抗体药物制备成皮下注射剂型已经不是新鲜事儿了,以“药王”Humira(阿达木单抗)为代表的多款自免重磅炸弹抗体药物均是通过皮下注射使用,包括TNF抑制剂、IL-17A抑制剂以及最新一代IL23 p19抗体;另外,降脂新药PCSK9抑制剂、多款用于治疗偏头痛的CGRP/CGRPR类药物也是在最初开发时便将剂型定位为SC,这主要是出于这些疾病多为慢性病,需长期用药的考虑。
除此之外,在已上市注射剂的基础上,进一步开发皮下注射剂型也是药企们发力的方向。在曲妥珠单抗静脉注射剂上市21年后,罗氏推出了皮下注射剂;GSK、武田、强生等制药巨头也采用了相同的策略。不过从获批时间上来看,皮下制剂的推出中间间隔也越来越短,这也进一步说明抗体药物皮下注射剂的开发技术日趋成熟。正如上文提及,这类药物不仅显著减少患者在院接受治疗的时间,使用的便利性也大大提高。从另一个角度来说,企业也能通过对新剂型专利的保护进一步延长这些重磅炸弹的生命周期。
FDA批准的抗体新药不同剂型上市时间
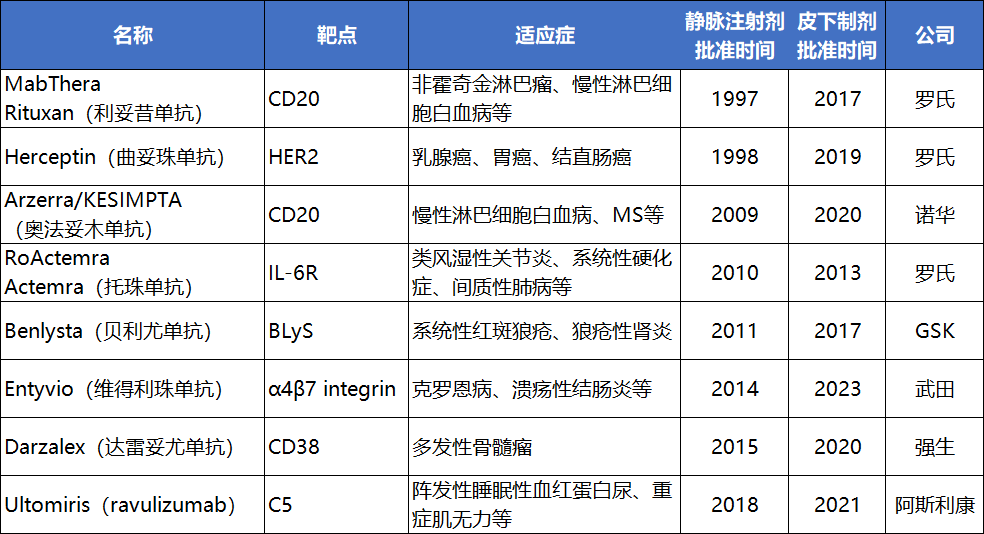
注:奥法妥木单抗2009年被FDA批准用于治疗慢性淋巴细胞白血病(CLL),以品牌名Arzerra销售,通过静脉注射给药;2020年获批治疗MS,以品牌名KESIMPTA销售,患者可居家自行通过自动注射笔用药
诺华则在皮下注射剂的基础上,再次开发了可居家使用的注射笔,奥马珠单抗最初以皮下注射剂批准,之后改良为预充式注射笔,患者可居家自行使用。同样地,诺华开发的第二代CD20单抗KESIMPTA(奥法妥木单抗)采用了Sensoready®自动注射笔,患者可在家完成注射,无需去输液中心,KESIMPTA也是首个实现患者自行注射的B细胞靶向疗法。强生的戈利木单抗(Simponi)、古赛奇尤单抗(Tremfya)则是在原有预充式注射器的基础上再次升级为预充笔式注射器。居家注射期间,患者可全程控制注射速度,隐藏式针头设计更人性化,患者心理接受度更高。
另一个十分值得注意的现象是,抗肿瘤抗体药物剂型的开发也逐渐向皮下注射剂转变。近两年强生开发的两款多发性骨髓瘤新药Tecvayli(特立妥单抗,CD3/BCMA双抗)和Talvey(talquetamab,CD3/GPRC5D双抗)以及辉瑞近日刚获FDA批准上市的CD3/BCMA双抗Elrexfio(elranatamab)首发剂型均是皮下注射剂。
目前全球已有多款抗肿瘤新药皮下制剂获批上市或正在临床研究阶段。除了前文提到了全球首款获批的皮下注射剂型PD-L1恩沃利单抗外,罗氏阿替利珠单抗皮下制剂也在昨日获英国英国药品和保健产品监管局(MHRA)批准上市,覆盖所有阿替利珠单抗注射剂已获批的适应症,包括某些类型的肺癌、膀胱癌、乳腺癌和肝癌。Tecentriq SC也是罗氏第4款获批上市的皮下注射型肿瘤治疗药物,放眼全球,产品获批数量也是遥遥领先。
全球获批上市/在研皮下注射型抗肿瘤单抗药物
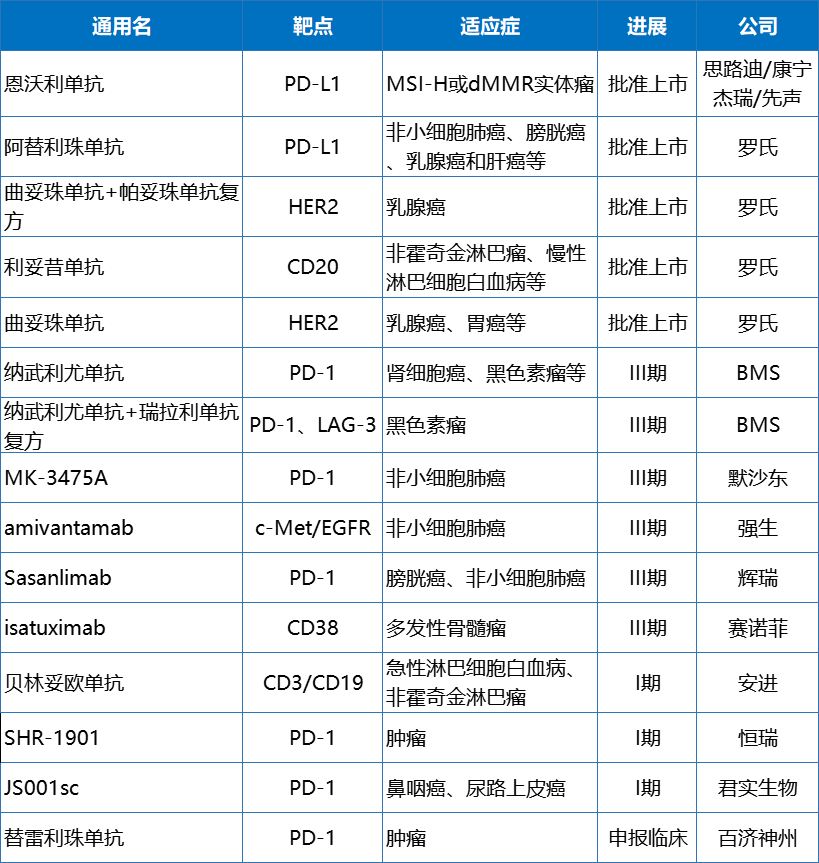
近两年,国内药企开发皮下注射PD-(L)1的消息也不绝于耳,君实生物特瑞普利单抗皮下注射液JS001sc已于2022年3月获批临床,恒瑞PD-1皮下注射剂SHR-1901正在开展临床研究,百济神州也于今年8月向NMPA递交了替雷利珠单抗皮下注射剂的2.1类临床申请.....抗体药物剂型改革的风也已经在中国PD-1药物中吹起。
总结
自免类疾病以及心血管疾病作为慢性病,为了方便患者长期用药,抗体药物的剂型基本上为皮下注射剂,有些产品甚至已经被开发成了患者可居家自行注射用笔。随着更多疗效更优产品的出现,恶性肿瘤正在逐渐向慢性病转变,未来门诊形式的肿瘤免疫治疗也将成为常规。抗体药物从静脉注射剂向皮下制剂的转变和优化也正是迎合了这一需求,助力癌症患者更便捷的疾病管理。
参考资料:
[1]. DOI:10.1371/journal.pone.0157957
[2]. DOI: 10.1016/j.clinthera.2017.05.342
[3]. Pivot X, et al. Ann Oncol 2014

 产业资讯
产业资讯
 识林
识林  2025-07-03
2025-07-03
 13
13

 产业资讯
产业资讯
 村夫日记LatitudeHealth
村夫日记LatitudeHealth  2025-07-03
2025-07-03
 14
14

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-07-03
2025-07-03
 14
14