 产业资讯
产业资讯
 一度医药
一度医药  2023-09-08
2023-09-08
 2733
2733
提到成立于2014年的再鼎医药,脑海里首先浮现的标签便是“License-in”。2017年,再鼎医药依托于“License-in”成功在纳斯达克上市,一跃成为中国创新药产业的佼佼者,2020年,再鼎医药在香港联交所二次上市,市值一度突破千亿港元。
只是成立十年,再鼎医药至今未能实现盈利。不过,再鼎医药不断在License-in之外探索,进行内部迭代,从“引进成熟产品的1.0时代”,步入“引进+研发的2.0时代”。四款产品商业化进程的持续推进,再鼎医药成功摘B,亏损不断收窄,随着近期两款产品获批接连上市,研发管线陆续进入收获密集期,再鼎医药加快了扭亏为盈的脚步,已然可以望见不远处的盈利拐点。
第五、第六款新药接连登场
第六款:马吉妥昔单抗
今年9月1日,再鼎医药的马吉妥昔单抗(Margenza)在华获批上市,联合化疗治疗已经接受过两种或两种以上抗HER2治疗方案的转移性HER2阳性乳腺癌成人患者,其中至少一种治疗方案用于转移乳腺癌,这是再鼎医药获批上市的第六款产品。
马吉妥昔单抗是再鼎医药通过License-in获得的,资料显示马吉妥昔单抗是MacroGenics开发,2018年11月,再鼎与MacroGenics就马吉妥昔单抗和另外2款单抗达成战略合作协议,再鼎负责马吉妥昔单抗在大中华区的开发及商业化。
马吉妥昔单抗具有与曲妥珠单抗相似的 HER2 结合和抗增殖作用,还通过 Fc 优化技术进行了工程设计,以增强其免疫系统的参与度,并利用抗体依赖性细胞介导的细胞毒性作用(ADCC)影响癌细胞的杀伤力。
早在2020年,马吉妥昔单抗已获得FDA批准上市,马吉妥昔单抗在美国和中国上市分别是建立在全球第三阶段的 SOPHIA试验以及中国 SOPHIA桥梁试验的基础之上。
SOPHIA的全球3期临床研究数据显示,与曲妥珠单抗联合化疗相比,马吉妥昔单抗联合化疗显著降低了患者的疾病进展或死亡的风险,具有统计学意义(HR=0.76),两组的中位无进展生存期(mPFS)分别为5.8个月和4.9个月。在客观缓解率方面,马吉妥昔单抗联合化疗组为22%,也高于对照组的16%。
另外,来自 SOPHIA中国项目的数据在2022中国癌症学会乳腺癌专题讨论会上发布。结果显示,马吉妥昔单抗和曲妥珠单抗分别为5.5和4.1,HR为0.69。另外,在 ORR及 CBR方面,马吉妥昔单抗比其治疗效果更好(25.5%对12.5%;32.7%对14.3%),安全性方面,两组患者相当。
SOPHIA中国临床试验发现马吉妥昔单抗具有较好的耐受性和有效性,这一点与 SOPHIA临床试验在世界范围内的结果相吻合。
据悉,全球乳腺癌患者中,HER2阳性占乳癌病例的25%。目前HER2阳性乳癌治疗的局限性包括二线抗HER2治疗失败后或出现疾病进展后,无有效疗法,以及HER2 阳性患者易复发及转移,特别是脑转移。
HER2 阳性转移性乳腺癌维持及治疗方案

图源:再鼎医药招股书
既往治疗HER2阳性晚期乳腺癌中,标准治疗手段为化疗药物+曲妥珠单抗/拉帕提尼,马吉妥昔单抗是唯一一款在与曲妥珠单抗头对头研究中显示出可延长PFS的抗HER2治疗方案,这就表明马吉妥昔单抗有望为难治型患者群体提供一项重要的新治疗选择,极具市场潜力。
根据弗若斯特沙利文数据,2020年乳腺癌新发患者达到226万人,成为全球第一大新发癌症;中国新发乳腺癌患者数量也逐年增高,预计2030年达到37万人。全球乳腺癌药物市场从2016年的215亿美元增长至2020年的318亿美元,复合年增长率为10.3%。预计在2025年增长至475亿美元,并在2030年达到710 亿美元。
随着马吉妥昔单抗上市,再鼎医药切入逐渐火热的乳腺癌赛道,马吉妥昔单抗比曲妥珠单抗更优的ORR和临床获益率(CBR)或将助力再鼎医药在乳腺癌药物市场大展拳脚。
第五款:艾加莫德
昨日,再鼎医药宣布艾加莫德正式在国内上市,从获批到上市只经历了67天。艾加莫德α注射液(efgartigimod)(商品名:卫伟迦)于6月30日获得国家药品监督管理局上市批准,与常规治疗药物联合用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者,成为再鼎医药在自身免疫领域里的第一款产品,也是再鼎医药在中国获批上市的第5款商业化产品。
艾加莫德是一款全球首创的FcRn拮抗剂,可竞争性的结合FcRn,促进致病性IgG的降解,成为所有重症肌无力靶点中,兼顾疗效与安全性的最佳选择。艾加莫德作为唯一的人IgG1的Fc片段衍生物,独特的作用机制,具有组织分布更广、免疫原性更低、空间位阻更小、亲和力更高和减少免疫激活的特点。
与马吉妥昔单抗一样,艾加莫德α注射液并非再鼎医药自研,而是由argenx开发,再鼎医药引进后拥有该药在大中华区(包括中国大陆、香港、澳门和台湾地区)的独家开发和商业化权利。
艾加莫德6月30日在国内获批,赶上了2023年医保谈判的末班车,进入了初审名单。海外投行Jefferies也给出了销售预估,随着艾加莫德进入医保谈判,这款产品可能在2024年为再鼎带来2500万至5000万美元的销售收入,未来艾加莫德在中国仅在全身型重症肌无力的销售峰值收入有望达到3-5亿美元,随着在ITP、CIDP等适应证的拓展,这一峰值收入有望进一步扩大。
艾加莫德的上市,为中国gMG患者带来全新的治疗选择,开创gMG靶向治疗新时代,同时,作为全球首款FcRn拮抗剂,艾加莫德有望成为2023年到2025年再鼎医药业绩增长的重要引擎。
License-in产品加速开花结果
截止目前,再鼎医药共有6款产品获批上市,值得一提的是,六款产品都是通过License-in获得,除了刚上市的艾加莫德和马吉妥昔单抗,其余4款产品均已成功商业化。
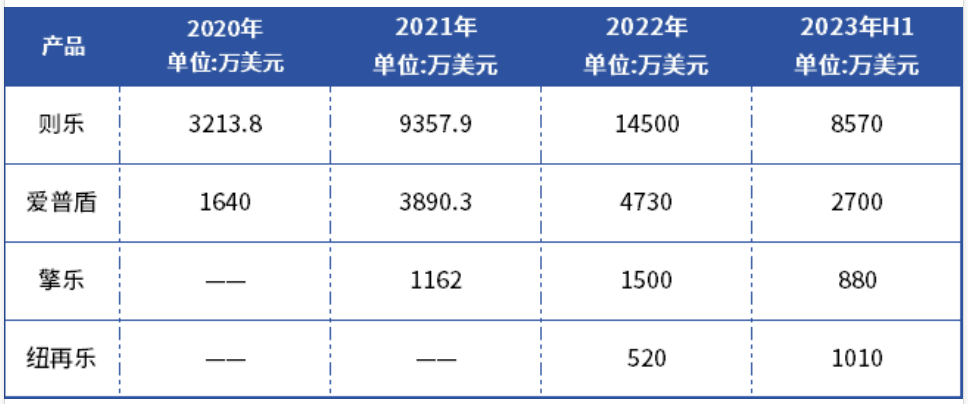
根据再鼎医药日前发布的2023H1及往年的业绩报告,再鼎医药营收主要来源于PARP抑制剂尼拉帕利(则乐)、肿瘤电场治疗(爱普盾)、治疗胃肠间质瘤的瑞派替尼(擎乐)、抗菌药甲苯磺酸奥马环素(纽再乐)这四款产品。
主要产品营收情况
图源:博药
2019年12月则乐上市;2020年5月爱普盾获批上市;2021年3月擎乐上市;2021年12月纽再乐上市,也就是说,在两年的时间内,再鼎医药推进4款创新产品相继在国内上市,速度之快让人惊讶。
从近几年营收情况来看,则乐、爱普盾、擎乐、纽再乐销售额均在逐年上涨;除爱普盾,其余3款均已进入医保。
则乐作为再鼎医药的首款商业化产品,也是国内唯一可用于卵巢癌全人群维持治疗的PARP抑制剂,2019年12月获批上市后很快就在2020年通过医保谈判进入医保目录,相关适应证进入国家医保目录,在2022年大大加速了产品的进院和放量,则乐销售彻底爆发,营收1.45亿美元,约合人民币10.15亿元,成为年售10亿的大单品,无疑是当下再鼎医药的营收主引擎。
爱普盾是唯一获FDA批准应用的电场治疗产品,主要通过对抗细胞的有丝分裂、DNA修复、血脑屏障渗透性等方式治疗多种肿瘤。但和药品相比,爱普盾在患者援助计划下年花费也要将近50万,目前尚无法进入医保报销,这导致爱普盾的市场推广速度较慢。
但再鼎医药在医保外为爱普盾“另辟蹊径”,通过“惠民保”来减轻患者负担。据统计,爱普盾已经被纳入87种不同的补充医疗保险计划,大部分能实现带病参保和报销。2022年,爱普盾为再鼎带来了4730万美元营收,同比增长21.6%,2023H1营收2700万美元,总之,爱普盾销售目前已步入正轨,业绩稳步上升。
此外,2022年擎乐和纽再乐正式纳入国家医保药品目录,已于2023年3月1日正式实施,其中2021年12月在国内上市的纽再乐2023H1营收1010万美元,是去年全年营收(520万美元)的两倍,增长势头迅猛,或将成为再鼎医药则乐之外的下一张王牌。
如今这四款License-in产品均已开花结果,再鼎医药的商业化能力得到市场的验证,按四大产品2023H1的营收数据看,不出意外,随着医保放量,今年营收将进一步增长。
“引进+研发”为盈利上双保险
根据2023H1财报,今年上半年再鼎医药实现营业收入1.3亿美元(折合人民币约9.5亿),同比增长38.74%。净利润方面,亏损总额为1.43亿美元(折合人民币约10.3亿),亏损较去年同期有所收窄约20%。
作为国内药企中主打license-in的典型代表,在历时10年的发展中走出了属于自己的“再鼎模式”。步入2023年,再鼎医药的License-in产品不管是已商业化的还是刚上市的,都在发力,再一次验证了再鼎医药在对优质项目的判断上富有长远的战略眼光。
但是完全依赖引进难免被行业诟病创新研发能力“腿短”,在内外因素影响下,再鼎医药在五年以前就开始自身的研发,培育自研产品,走自主研发+外部合作的双驱动路线。
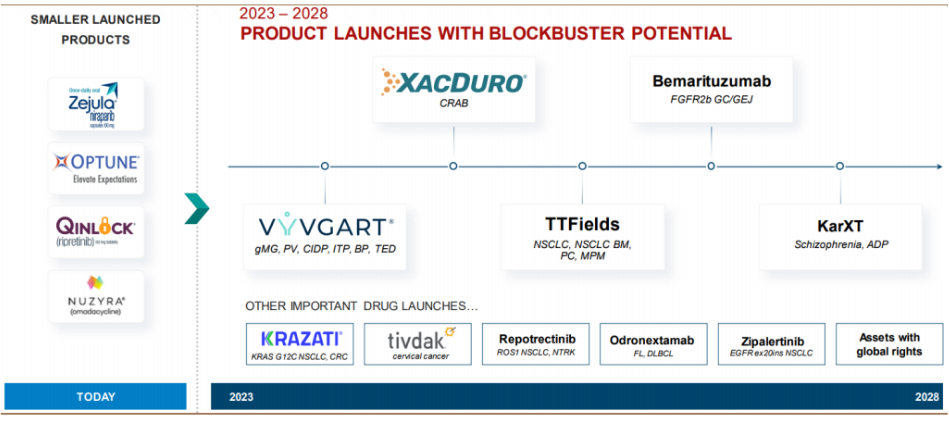
目前,再鼎医药正在进行或计划进行的临床研究超50多个,拥有全球权利的内部研发项目9个,已上市产品有6款,研发管线涉及有肿瘤、感染性疾病、中枢神经系统疾病、自身免疫性疾病等四大治疗领域。
再鼎医药产品布局
图源:官网
除已上市6款产品,还有多个产品处于临床三期或关键期临床阶段:KRAS G12C抑制剂Adagrasib, FGFR2b抑制剂Bemarituzumab,CD3XCD20双抗、Trop-2 ADC、精神分裂症新药KARXT、ADC宫颈癌新药Tivdak等,有望于在未来两年申报上市。今日,再鼎医药刚宣布Tivdak全球Ⅲ期临床研究达到主要研究终点,该研究结果将在即将召开的医学会议上展示,并用于与美国药品注册监管机构的讨论。
另外,再鼎医药在自研项目上的布局也不容小觑,以ZL-1102为代表的自研管线正在推进,ZL-1102 是再鼎医药于2018 年从Crescendo 获得全球独家许可的一款新型全人源VH 抗体片段,是第一个靶向IL-17A 针对轻中度慢性斑块状银屑病患者的局部治疗药物,作为再鼎内部研发的产品,是其第一个进入全面全球开发的候选药物。2021 年10 月,再鼎医药完成了用于银屑病的临床1b 期研究概念验证,预计今年启动全球第二阶段研究实验。
未来2-3年,再鼎将进入后期管线获批的爆发阶段,预计会有至少8款产品在中国获批。
结语
这一两年,资本市场的寒气让医药企业“人人自危”,但面对估值下调与融资寒冬,再鼎医药依旧从容淡定,此番艾加莫德和马吉妥昔单抗的接连上市,再鼎医药再一次迎来产品上市密集期,相信在其优秀商业化团队的催化下,艾加莫德和马吉妥昔单抗能尽快落地,并开花结果。
整体来看,不断提高的产品营收和持续收窄的亏损数额都在释放着积极的信号:再鼎医药实现盈利的时刻不久就要到来,让我们拭目以待。
参考资料:
1、再鼎医药官网,财报
2、《半年营收9.5亿,四大产品支撑,再鼎医药管线前景如何?》博药,2023年8月11日
3、《再鼎医药「马吉妥昔单抗」获批上市》医药魔方,2023年9月1日

 产业资讯
产业资讯
 健识局
健识局  2025-06-20
2025-06-20
 28
28

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-06-20
2025-06-20
 31
31

 产业资讯
产业资讯
 同写意
同写意  2025-06-20
2025-06-20
 31
31