 产业资讯
产业资讯
 医药魔方
医药魔方  2023-09-20
2023-09-20
 3598
3598
制药巨头的研发布局动作通常会被视为行业热点的风向标,其一举一动都会牵动着整个行业“敏感”的神经。
2023年以来,制药巨头们对炎症性肠病(Inflammatory Bowel Disease,IBD)纷纷加码布局。4月,默沙东以总交易额108亿美元收购Prometheus Biosciences获得其核心管线——一款治疗IBD的TL1A抗体PRA023;6月,礼来以24亿美元的价格收购DICE Therapeutics,囊获包括治疗银屑病的IL-17小分子抑制剂、治疗IBD的α4β7单抗在内的多款自免药物;7月,华尔街日报称罗氏将与Roivant Sciences达成合作协议,以超70亿美元的价格收购TL1A抗体RVT-3101。
默沙东、礼来、罗氏相继掷重金选择IBD药物来补齐自免疾病管线的缺口,不禁让行业把目光再次聚焦到了IBD赛道。
临床需求支撑的百亿美元市场
IBD是一种病因不明的非特异性慢性肠道炎症,其中最主要的两种类型是溃疡性结肠炎(UC)和克罗恩病(CD)。IBD常见症状是严重腹痛、腹泻、营养不良等。不仅如此,IBD还会影响身体其它部位,如关节、眼睛、口腔、肝脏、胆囊和皮肤,同时还可能会增加肠道受累部位癌变的风险。
流行病学数据显示,目前全球约有600~800万IBD患者,其中欧洲IBD患者已超过300万,美国IBD患者超过200万[1,2]。IBD曾被认为是西方国家的特有疾病。但随着过去十几年间社会因素的变化,包括中国、印度在内的亚洲国家IBD发病率也在迅速增加;不仅如此,未来十年间,这些亚洲国家的IBD发病率很可能会呈指数级增长。研究推测,如果按照平衡期0.1%的患病率计算,到2025年,中国将有近150万IBD患者[3]。
IBD受到遗传、环境、肠道微生态、免疫等因素的共同影响,病理过程复杂,目前仍没有找出最具说服力的主要致病机理,这也导致IBD的临床治疗手段相对有限。IBD的传统治疗药物包括糖皮质激素、抗生素、免疫抑制剂、氨基水杨酸等,随着靶向TNF-α的英夫利西单抗和阿达木单抗获批UC/CD适应症后,IBD也进入了“生物制剂”时代。
在此之后,IL-12抗体乌司奴单抗、α4β7抗体维得利珠单抗、JAK抑制剂乌帕替尼等药物的相继获批,填补了对传统治疗或TNF-α抗体药物应答不足或无法耐受的IBD患者的治疗空白。但IBD具有极高的复发率,80%患者会慢性复发,20%~30%患者在多次复发后不得不进行手术治疗,切除部分肠道,这严重影响了患者的生活质量。
因此,目前IBD患者仍有着巨大的未满足临床需求,迫切需要开发有效的治疗方法来解决这一全球健康问题。Roivant数据显示,2021年仅美国IBD药物市场规模就达到了150亿美元。
在此之中,艾伯维、强生分别凭借阿达木单抗和乌司奴单抗在自免领域的“广谱”属性以及武田依靠维得利珠单抗的肠道特异性已在IBD赛道独占鳌头,三款药物在IBD适应症上的总销售额达到120亿美元。据Evaluate Pharma预测,2028年全球自免药物市场规模将达到1400亿美元,其中IBD药物市场规模将达到280亿美元,占据20%的市场份额。
患者人群的增加、现有疗法的不完美、自免疾病患者高支付意愿的属性都为IBD赛道玩家留下了巨大的想象空间。医药魔方数据库显示,目前进入临床阶段的IBD在研药物已超过280款,但其中绝大多数为自免领域已获批药物的适应症拓展。这一背景之下,手握兼顾疗效&安全性的IBD创新药玩家正在酝酿着重塑IBD市场格局的新机会……
TL1A:IBD赛道的实力黑马
TL1A(TNFSF15)是肿瘤坏死因子(TNF)家族成员之一,其广泛表达于单核细胞、巨噬细胞、树突细胞、T细胞等免疫细胞。TL1A通过结合其功能性受体——死亡受体3(DR3)来转导下游信号参与免疫调节,TL1A/DR3信号系统已成为粘膜免疫的重要模块,参与维持肠道稳态。然而,TL1A/DR3信号系统的过表达会导致肠道粘膜炎症产生,促进慢性炎症、纤维化反应的发展和维持[4,5]。
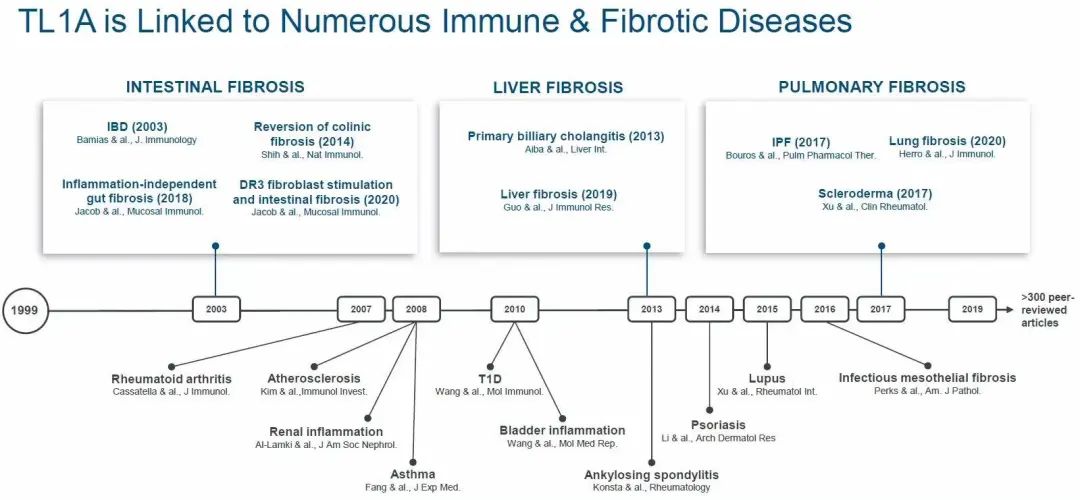
TL1A与免疫、纤维化疾病联系(来源:Prometheus)
肠道纤维化是慢性炎症的结果,也是IBD最常见的并发症之一。因此,实现抗炎、抗纤维化则很有可能有效抑制或逆转IBD的疾病进程。
Prometheus和Roivant正是独具只眼地将TL1A抗体抗炎、抗纤维化的双重特性地转化到了IBD适应症的临床开发中。
TL1A单抗PRA023正是Prometheus的核心产品,其对人TL1A具有高亲和力和特异性。2022年12月,Prometheus公布了PRA023治疗UC的II期ARTEMIS-UC研究及治疗CD的IIa期APOLLO-CD研究的积极结果。ARTEMIS-UC是一项为期12周的双盲、安慰剂对照的II期研究,旨在评估PRA023在传统疗法或生物制剂治疗失败的中重度活动性UC患者的疗效和安全性。数据显示,Cohort1(不划分生物标志物阳性的所有患者人群)达到主要和所有次要终点。
实验组26.5%的患者达到了临床缓解的主要终点,而对照组这一数值为1.5%(p<0.0001);实验组36.8%的患者达到内镜缓解的次要终点,而安慰剂这一数值为6.0%(p<0.0001)。安全性方面,PRA023耐受性良好,未报告治疗引发的严重不良事件(SAE)。APOLLO-CD试验是一项为期12周的开放标签研究,纳入了55名在传统疗法或生物制剂治疗失败的中重度活动性CD患者。数据显示,实验组49.1%的患者实现临床缓解,而安慰剂组为16%(p<0.001);实验组26.0%的患者内镜缓解,而安慰剂组为12%(p=0.002)。APOLO-CD研究中,患者对PRA023耐受性同样良好。
PRA023在UC/CD两项适应症的积极成果拉动了Prometheus股价大涨166%,总市值达到40亿美元。但对于Prometheus来说,这两项研究成功的意义远不止此。亮眼的数据叠加潜在的BIC属性成功吸引了默沙东的视线。2023年4月,默沙东以200美元/股的价格收购Prometheus,接近翻倍的溢价也使总金额高达108亿美元。素来在自免领域“平平无奇”的默沙东选择IBD赛道切入自免领域,也足够让该赛道进入到更多药企的视线。RVT-3101则是Roivant子公司Telavant与辉瑞合作开发的一款皮下注射TL1A单抗药物。
Telavant全权负责RVT-3101的后续开发并拥有该药物在美国和日本的商业化权利,辉瑞持有Telavant 25%的股份并拥有RVT-3101在美国和日本以外的商业化权利。2023年6月,Riovant公布了RVT-3101治疗中重度UC的II期TUSCANY-2研究数据。该研究为期56周,前14周为诱导期,之后为持续42周的维持治疗期。
研究结果显示,在第56周时,在诱导期和维持期接受RVT-3101治疗的所有患者中,临床缓解率为36%(14周为29%),内窥改善率为50%(14周为36%),内镜缓解率为21%(14周为11%);在生物标志物阳性患者中,第56周时临床缓解率为43%(14周为33%),内镜改善率为64%(14周为47%),内镜缓解率为36%(第14周为13%)。安全性方面,所有剂量RVT-3101耐受性均良好,没有患者在治疗后产生中和抗体。
横向对比来看,RVT-3101 14周诱导期的疗效数据相较于PRA023 12周诱导期的疗效数据略显优势(治疗组相对安慰剂组改善比例)。安全性方面,二者的耐受性均良好,不过PRA023治疗的SAE发生率更低。刚刚接手PRA023的默沙东目前正在与FDA讨论II期研究的数据结果,预计将于2024年第一季度启动UC适应症的III期研究。而目前RVT-3101的临床开发主要还是依靠Roivant,如果其成功被罗氏收购,TL1A赛道也将迎来默沙东、罗氏两家头部MNC的角逐战。
不过,在TL1A赛道中,究竟谁才是真正的BIC还需要等待样本量更大的III期试验数据公布时才能揭晓。Teva的TL1A单抗TEV-48574目前也已进入临床II期,预计2024年下半年公布中期数据。在试验进度方面,TEV-48574已经明显较RVT-3101和PRA023落后了一个身位。除此之外,安进的TL1A/TNF-α双抗AMG 966,辉瑞的TL1A/IL12双抗PF-07261271均已进入I期临床。
自免多面手,相逢IBD
免疫细胞对肠道粘膜的攻击也是导致IBD的重要原因之一,选择性1-磷酸鞘氨醇(S1P)受体调节剂可以通过靶向S1P受体,阻断淋巴细胞迁移到肠道粘膜,从而降低炎症反应[6]。
Ozanimod是BMS研发的首款获批用于治疗UC的口服S1P受体调节剂。III期Ture North研究数据显示,治疗10周时,Ozanimod组患者的临床缓解率为18.4%,安慰剂组为6.0%;治疗52周时,Ozanimod组患者的临床缓解率为37.0%,安慰剂组为18.5%。
Etrasimod是辉瑞/云顶新耀共同开发的一款口服S1P受体调节剂,目前辉瑞已基于III期ELEVATE UC 52和ELEVATE UC 12研究的积极数据向FDA递交了该药物治疗UC的上市申请。ELEVATE UC 52包括前12周的诱导期和后40周的维持期,ELEVATE UC 12仅包括12周的诱导期。
ELEVATE UC 52研究结果显示,第12周时,etrasimod组患者的临床缓解率为27.0%,安慰剂组为7.4%;第52周时,etrasimod组患者的临床缓解率为32.1%,安慰剂组为6.7%。ELEVATE UC 12研究结果显示,etrasimod组患者的临床缓解率为24.8%,安慰剂组为15.2%。
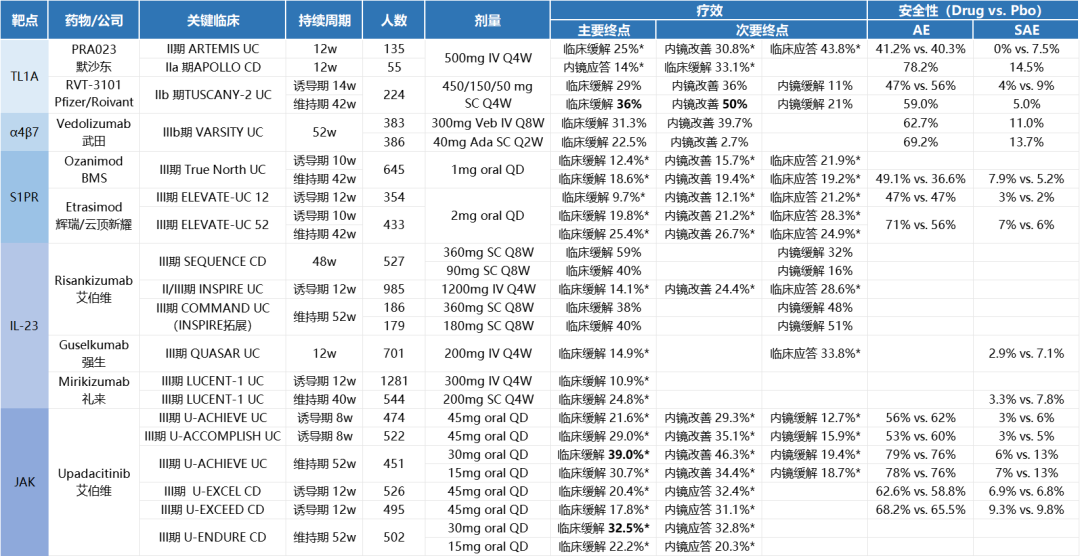
注:部分IBD药物关键临床研究数据对比(*数据为安慰剂调整后数据)
对比ozanimod、etrasimod两款这S1P受体调节剂与前文提到的TL1A抗体的疗效数据来看,S1P受体调节剂在疗效上大打折扣,安全性也没有明显优势。但从长远来看,口服S1P受体调节剂在依从性、治疗成本方面显然对患者更加友好。
Janus激酶信号转导和转录激活因子(JAK-STAT)信号通路与IBD的生理病理中涉及的多种细胞因子的下游信号转导密切相关。阻断JAK-STAT信号通路的药物,如JAK抑制剂(JAKi)乌帕替尼、托法替尼等已应用到IBD的临床治疗中。然而,JAK抑制剂最大的问题就是长期使用的安全性风险,FDA也因此对乌帕替尼、托法替尼、巴瑞替尼等JAKi发出了黑框警告。BMS研发的口服TYK2抑制剂氘可来昔替尼能够特异性地抑制TYK2蛋白,而对其它JAK蛋白几乎无抑制活性,从根源上减少了泛抑制带来的安全性问题。
TYK2抑制剂的安全性优势是进军IBD等慢病领域药物的先天优势,BMS自然也没有错过这个诱人的市场机遇。然而,氘可来昔替尼在UC适应症的研发并不顺利。2021年10月,BMS宣布氘可来昔替尼治疗中重度UC的II期LATTICE-UC研究(IM011-024)未达到第12周时临床缓解的主要终点和次要终点。
但BMS并未放弃氘可来昔替尼在IBD适应症上的开发计划,两项治疗IBD患者的II期IM011-077研究和IM011-127研究仍在同步进展当中。除氘可来昔替尼外,辉瑞/Priovant的JAK1/TYK2抑制剂brepocitinib、杭州高光制药的JAK1/TYK2抑制剂TLL-018、Ventyx Biosciences的TYK2抑制剂VTX-958也开展了IBD适应症的临床研究。
“广谱”有效的IL-23单抗自然也不会放弃瓜分IBD市场份额的机会。近期,艾伯维宣布IL-23p19单抗利生奇珠单抗(risankizumab)对比乌司奴单抗治疗中重度CD的III期SEQUENCE研究达到了所有的主要终点和次要终点。强生的Guselkumab(UC/CD适应症III期)、礼来的Mirikizumab(UC适应症日本获批,CD适应症III期)均在同步开展着IBD适应症的临床研究。
值得一提的是,基于对IBD领域的竞争格局分析,阿斯利康在今年6月终止了IL-23单抗brazikumab的临床开发,针对CD适应症的IIb/III期INTREPID研究和UC适应症的II期EXPEDITION研究均因此被终止。
总结
面对IBD赛道背后蕴含的百亿市场,全球药企已然敏锐地捕捉到了这个新机遇,展开了研发速度卡位战。然而,相较于全球IBD创新药的捷报频传,国内药企的进展却相对缓慢。医药魔方数据库显示,国内公司在研的进入临床阶段IBD创新药物仅有30余款,且大多数尚处于临床早期。
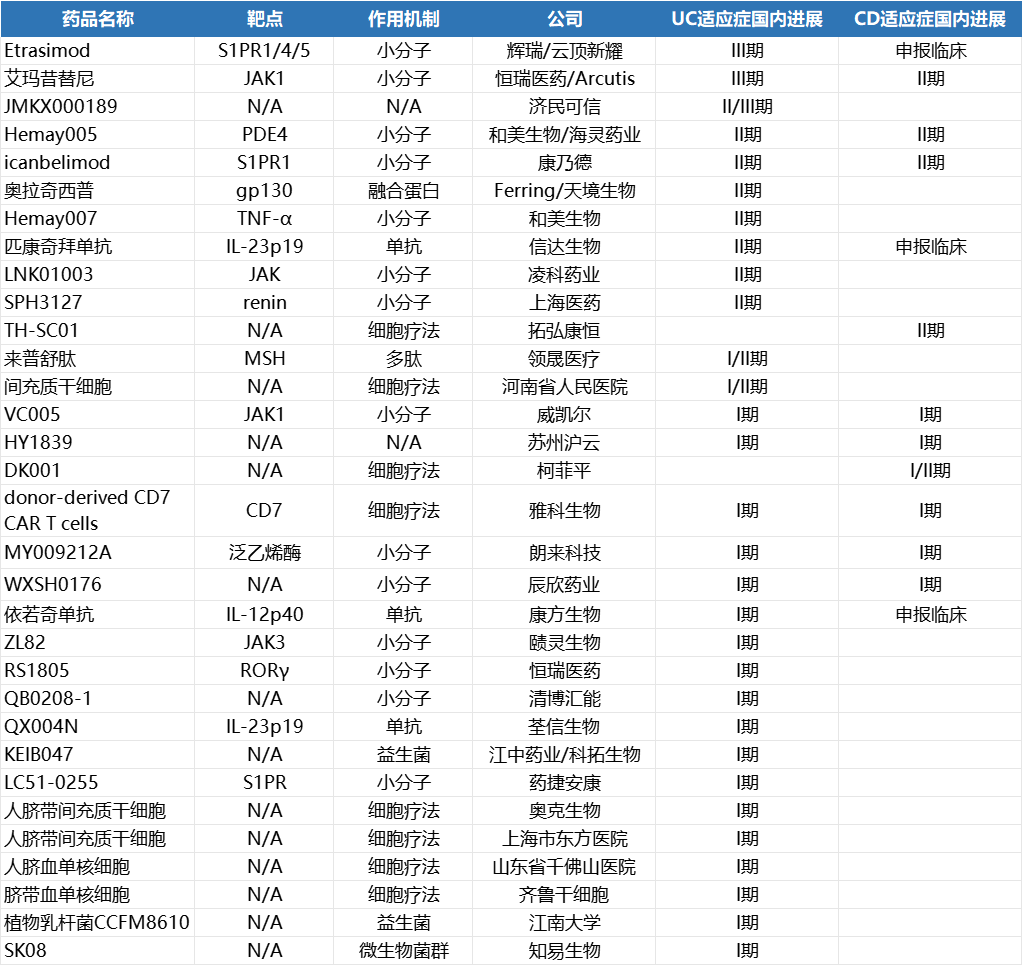
国内公司在研IBD药物进展
相较于糖尿病、肥胖、高血脂等慢病领域创新药研发的内卷程度,国内自免赛道的竞争相对缓和。IBD在中国人群的发病率逐年提高,必然会随之催生出更加迫切的临床需求。对于创新药企来说,目前尚未拥挤的IBD赛道不失为入局自免领域的一个切入点。未来这个赛道将迎来怎样的革新和挑战,我们也将拭目以待。
参考资料
[1] Doi:10.1111/jgh.14872
[2] Doi:10.1038/s41575-020-00360-x
[3] 薛林云, 欧阳钦, 黄中华, et al. 近20年中国IBD研究进展——20年文献总结[J]. 国际消化病杂志(4):63-65.
[4] Doi:10.3389/fimmu.2022.891328.
[5] Doi:10.1080/1744666X.2022.2074401
[6] Doi:10.1056/NEJMoa2033617.

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 114
114

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 103
103

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 93
93