 产业资讯
产业资讯
 医药魔方
医药魔方  2023-11-22
2023-11-22
 2940
2940
近两年,医药行业虽然遭遇寒冬,但身处各个细分赛道中的公司对于大环境的体感温差还是略有不同。有的公司因为开发的产品过于同质化而面临融资和生存困难,有的公司则因为踩中ADC、GLP-1这些现象级风口继续受到机构追捧。对此,我们也可以认为是存量资本在寻找最有市场想象力和商业回报的投资方向。
在当前不那么多的行业明灯中,核药这一小众赛道悄然升温,颇受制药企业和投资人青睐。根据医药魔方数据库,2023年核药赛道的融资金额已经达到了60亿美元。此外,诺华、礼来、强生等MNC或通过并购合作,或通过股权投资,也在不断加码核药,呈现出一派欣欣向荣的景象。
百亿美元核药赛道的兴起
医药行业每个革命性疗法乃至重大创新背后都有数十年的积累。核药的兴起亦是如此。核药又称放射性疗法,是一类含放射性核素,供医学诊断或治疗用的特殊药物。它的起源最早可以追溯到十九世纪末伦琴发现X射线,后来在居里夫妇、贝克勒尔(Becqyerel)、劳伦斯(Lawrence)等众多杰出科学家的不懈努力下,放射性元素、同位素示踪技术等科学发现相继面世,其医疗使用成为现实。
1951年,全球首个核药碘[131I]化钠获FDA批准上市,主要用于甲状腺疾病的诊断和治疗。此后几十年,随着发射重建层析成像技术(后来被称为SPECT和PET)的出现以及碘[123I]氟潘、18F-FDG、英西单抗、阿西莫单抗、Locametz等产品的获批,核药在诊断方面的应用进一步加深。
与此同时,治疗端受限于上游核素产能、监管要求过严和安全性存疑等原因,发展却始终有些停滞不前。直到21世纪初期,放射性免疫治疗的概念出现,为淋巴瘤患者提供了一种新的治疗方式。Zevalin(替伊莫单抗)和Bexxar(碘[131I]托西莫单抗)相继在2002年和2003年获FDA批准上市,用于治疗非霍奇金淋巴瘤。遗憾的是,尽管安全性和疗效都不错,但由于当时市场教育不足、医保报销困难等,这两款产品的商业化并不成功。
转折发生在十年后,2013年Xofigo(氯化镭[223Ra])获批用于伴症状性骨转移且无已知内脏转移的去势抵抗性前列腺癌患者,治疗用核药才开始进入腾飞阶段。Xofigo是全球首款且唯一一款获批的α粒子放射性药物,主要通过活性部位模拟钙离子,然后结合羟基磷灰石(HAP)沉积区域发挥治疗作用。自2013年上市后,Xofigo销售额便稳步上升,2017年达到4.71亿美元。
不过,虽然Xofigo将核药重新带到了大家的视线中,但它毕竟属于传统放射性治疗药物,在前列腺癌展现出的疗效不适用也不能转化为其他癌症治疗,开发前景和市场空间有限,因此未能引起企业的广泛跟进。真正点燃该赛道的是两款新型靶向放射性疗法(也被称为放射性核素偶联药物,即RDC)Lutathera和Pluvicto的面世。这两款药物通过靶向分子将放射性核素递送至肿瘤细胞组织,近距离精准杀伤癌细胞,不仅高效低毒,还让行业看到了此类产品在其它靶点和适应症拓展的潜力。
进入市场后,Lutathera和Pluvicto的商业表现同样不俗。在上半年生产短缺以及新患者启动工作暂停的情况下,2023年前三季度Pluvicto仍取得了7.07亿美元销售额的优秀成绩。不出意外的话,Pluvicto全年销售额将超过10亿美元,成为放射性药物领域首个重磅炸弹。Lutathera前三季度的销售额增长也十分迅猛(+34%),达到了4.58亿美元。
RDC成为MNC开发重点
靶向放射性疗法(又称RDC)通常由靶向分子、连接子、螯合物和放射性核素四部分组成,可以像GPS定位的制导导弹一样瞄准肿瘤细胞进行诊断和治疗,具有精准靶向、强力杀伤和有限损伤的优点。此外,由于有效载荷是核素,RDC还具有诊疗一体的独特优势,能够通过在同一配体上更换核素改变诊断和治疗用途,实现“可见即可治,可治即可见”的目标,比如连接氟[18F]、镓[68Ga]等构成诊断产品,在极短时间内获得肿瘤病灶的医学影像结果;连接α或β粒子(镥[177Lu]、锕[225Ac]、碘[I-131]、镭[Ra-223]等)构成治疗产品,近距离精准杀伤癌细胞。
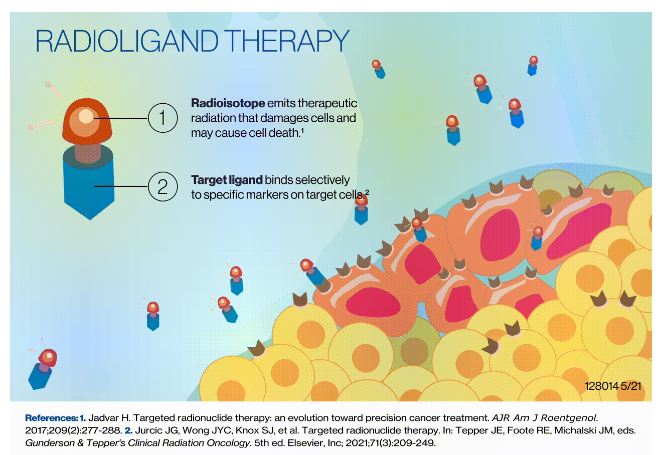
RDC的作用机制(来源:诺华官网)
坚实的科学基础和独特的诊疗优势,再加上已有产品经过临床和市场双重验证,多重因素影响之下,RDC如今已成为核药中最具发展潜力的方向之一,预计到2030年市场规模将达到200亿美元。诺华、拜耳、礼来、强生等MNC都豪掷重金在该领域有所布局。具体来说,诺华是RDC领域当之无愧的王者,不仅通过收购快速搭建起了放射性配体疗法技术平台,还手握Lutathera和Pluvicto两款畅销产品。据悉,Lutathera在2018年1月获FDA批准用于治疗SSTR阳性的胃肠道胰腺神经内分泌瘤(GEP-NETs),是全球首款上市的RDC。
Pluvicto则在2022年3月获FDA批准用于治疗既往接受过ARPI和紫杉烷类化疗且PSMA阳性的去势抵抗性转移前列腺癌(mCRPC)患者,被诺华寄予厚望,也即将成为首个跻身十亿美元分子俱乐部的RDC。诺华在核药领域达成的并购合作

近期,Lutathera和Pluvicto相继传来的利好消息更是让诺华坐稳了RDC的头把交椅。今年9月,Lutathera一线治疗SSTR阳性、2/3级GEP-NETs的III期临床NETTER-2研究达到了PFS主要终点和ORR关键次要终点。
10月,Pluvicto治疗既往接受过ARPI且PSMA阳性mCRPC患者的III期PSMAfore研究结果在2023 ESMO大会上公布,展现出了超过2倍的rPFS获益,诺华计划在2024年寻求该适应症的批准。除已上市的两款RDC外,诺华还有177Lu-FAP-2286、177Lu-NeoBOMB1、225Ac-PSMA-617等产品在研。
公司官网显示,177Lu-FAP-2286靶向成纤维细胞激活蛋白(FAP),目前正在实体瘤中开展I/II期临床研究;177Lu-NeoBOMB1靶向胃泌素释放肽受体(GRPR),正在乳腺癌、前列腺癌等适应症中进行早期临床研究。225Ac-PSMA-617则选用杀伤力强、射程短的α核素,相比Pluvicto在肿瘤治疗中更具优势。
拜耳涉足核药领域相对较早,十年前就推出了Xofigo,而后又大手笔收购Algeta、Noria和PSMA Therapeutics继续加磅RDC,如今已然成为该赛道的先行者和领导者之一。拜耳在近期举办的研发日会议上介绍,目前公司共有7个处于临床前阶段和2个处于早期临床阶段(BAY 3546828、BAY 3563254)的RDC在研。
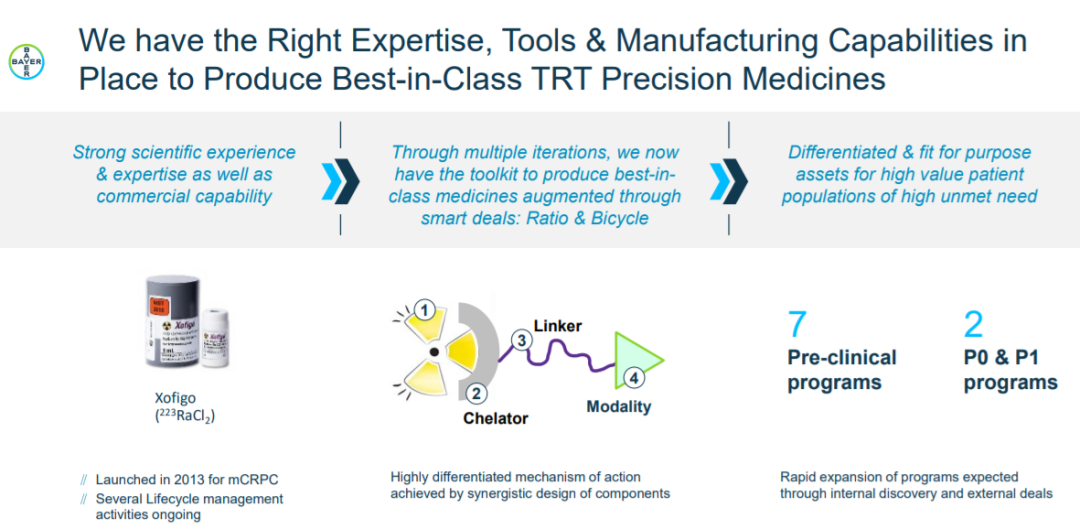
拜耳核药领域布局(来源:公司官网)
BAY 3546828和BAY 3563254都是Ac225标记PSMA靶向的RDC,其中前者在上个月刚启动在前列腺癌患者中的I期临床,计划入组140名受试者,包括177Lu-PSMA核药耐药的患者。

在糖尿病和肥胖领域拔得头筹的礼来也于近期用一笔高达14亿美金的收购打响了靶向核药的第一枪。10月3日,礼来宣布与核药公司POINT Biopharma达成协议,以每股12.50美元溢价68%的价格收购后者。
通过此次交易,礼来获得了多款RDC,包括两款处于临床后期的PNT2002和PNT2031,POINT下一代放射性配体疗法技术平台和相应的核药供应链。
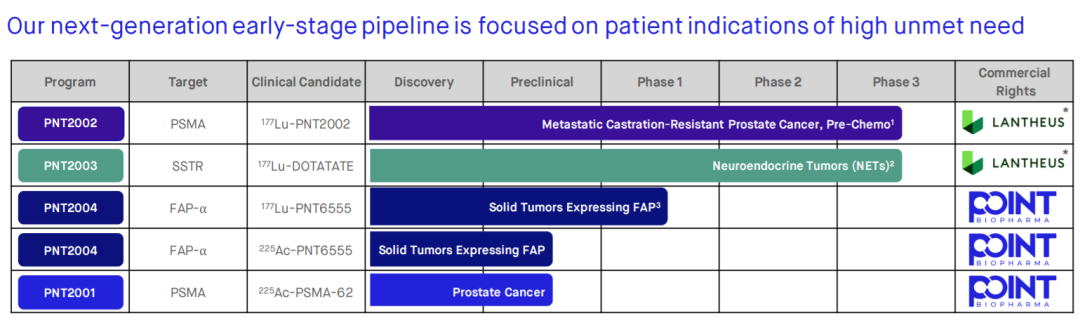
POINT产品管线(来源:公司官网)
阿斯利康、默沙东、强生等MNC通过股权投资、技术引进多种方式也切入了核药领域。2020年11月,阿斯利康与Fusion达成开发和商业化下一代α粒子靶向放射性疗法和癌症联合疗法的合作。今年4月,双方联合开发的FPI-2068(靶向EGFR和cMET)正式步入临床阶段。
默沙东也曾在2021年5月与Fusion就FPI-1434联合Keytruda治疗表达IGF-1R实体瘤患者达成临床试验合作,此外还参与了ImaginAb、Aktis Oncology的融资。强生则在2017年领投了Fusion的A轮融资,并于今年7月从Nanobiotix公司获得了同类首创放射治疗增敏剂NBTXR3的全球许可。
结语
MNC加快布局核药赛道时,国内药企也在紧锣密鼓地进场。除中国同辐、东诚药业等老牌核药企业外,远大医药、恒瑞医药、科伦药业、先通药业等传统药企希望能够通过RDC弯道超车实现创新转型,辐联医药、核欣医药、艾博兹医药、瑞迪奥等新生代核药公司在政策和资金红利的驱动下也如雨后春笋般涌现出来。
未来,随着越来越多RDC上市和产业链的完善,高效低毒、诊疗一体的靶向核药势必会成为新一代癌症主流疗法。至于谁能抢夺先机,获得更多收益,还需要时间来证明。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 124
124

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 115
115

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 102
102