 产业资讯
产业资讯
 医药时间
医药时间  2023-12-15
2023-12-15
 2657
2657
12月13日,日本卫生部官员表示,阿尔茨海默病新药Lecanemab(仑卡奈单抗,商品名:乐意保/Leqembi)在日本定价298万日元(约20,500美元)/年,该药将于12月20日在日本正式上市。

据悉,lecanemab大部分治疗费用将由公共医疗保险支付,接受治疗的患者将根据年龄和收入自费支付10%至30%的费用。据估计,日本每年有多达32,000名患者可以使用该药物,其在日本的市场或将达到近千亿日元。

阿尔茨海默氏症药物lecanemab(照片提供:卫材株式会社)
此外,lecanemab的使用剂量基于患者的体重,每年298万日元的费用是以体重50公斤的患者计。值得一提的是,在美国使用lecanemab的每位患者每年的价格为26,500美元;中国方面,lecanemab是按瓶计价,落地海南博鳌乐城国际医疗旅游先行区的“乐意保”定价3328.2元/瓶。
阿尔茨海默病是一种起病隐匿、呈缓慢渐进性加重的神经系统退行性疾病,是老年痴呆疾病中最为常见的一种,多发于65岁以上的老人,该疾病临床表现为记忆障碍、失语、失认、视觉空间损害、执行功能障碍、人格和行为改变,且随着时间的流失不断恶化,是不可逆的神经退行性疾病,目前暂无法通过一些治疗方式使其恢复至正常人水平。
Leqembi是日本卫材药业(Eisai)和美国渤健公司(Biogen)联合开发的靶向β-淀粉样蛋白(amyloidβ-protein,Aβ)的用于治疗早期阿尔茨海默病的新药。该药物是一种人源化免疫球蛋白γ 1 (IgG1)单克隆抗体,是首个也是唯一被批准的治疗方法,通过选择性结合和消除AD中导致神经毒性的毒性最强的Aβ聚集体(原纤维),显示出降低疾病进展速度和减缓认知和功能下降的效果。在临床试验中,该疗法在18个月内将早期阿尔茨海默病引起的认知能力下降减缓了27%。
此前,Leqembi在日本的上市申请于2023年1月提交,随后作为轻度认知障碍和阿尔茨海默病导致的轻度痴呆的治疗方法获得优先审查;2023年9月,日本药品和医疗器械管理局(PMDA)正式批准了仑卡奈单抗上市。日本是继美国于2023年7月正式批准后第二个批准Leqembi上市的国家。2023年10月,Leqembi正式通过海南省药品监督管理局审核,落地海南博鳌乐城国际医疗旅游先行区(以下简称“海南乐城”),商品名为“乐意保”。
据《2022年世界阿尔茨海默病报告》显示,目前全球有5500多万人被诊断患有阿尔茨海默病,预计到2050年,这一数字可能会超过1.3亿。与此同时,全世界每年新诊断阿尔茨海默病患者1000万例,即每3.2秒就会新增一位阿尔茨海默病患者。此外,据市场情报公司MordorIntelligence的一项统计数据显示,2021年阿尔茨海默病诊断和治疗市场近70亿美元,预计到2027年将高达近97亿美元,预计复合年增长率5.5%。
攻克阿尔茨海默病,是当今世界尚未实现的梦想之一。但由于病因复杂,科学界至今仍未破译阿尔茨海默病发病的具体机制,阿尔茨海默病也被认为是医药研发的“天坑”领域,多家MCN药企曾宣布停止阿尔茨海默病药物的研发工作,包括辉瑞、强生、阿斯利康等企业。此外,根据美国药物生产与研发协会的一份报告,在过去长达20年间,研发治疗和预防阿尔茨海默病药物的尝试失败约146次,投入的超6000亿美元研发费仿佛扔进黑洞,失败的临床药物超过300种,失败率高达99.6%。
尽管是研发“黑洞”,但包括阿尔茨海默病在内的神经退行性类疾病,是近几年全球知名药企竞相投入研发的一大热点。一方面是未被满足的临床需求,另一方面是广阔的市场前景,持续推动着全球研发企业争相加入。
全球已上市药物方面,2021年6月,渤健的阿杜那单抗(aducanumab)为第一个上市能延缓AD进程的药物;2023年7月,仑卡奈单抗(lecanemab)成为首款被证明可让早期阿尔茨海默病患者的认知能力下降速度减慢27%的上市新药。此外,2023年7月,礼来已申请FDA全面批准其治疗AD的新药多奈单抗(donanemab)。
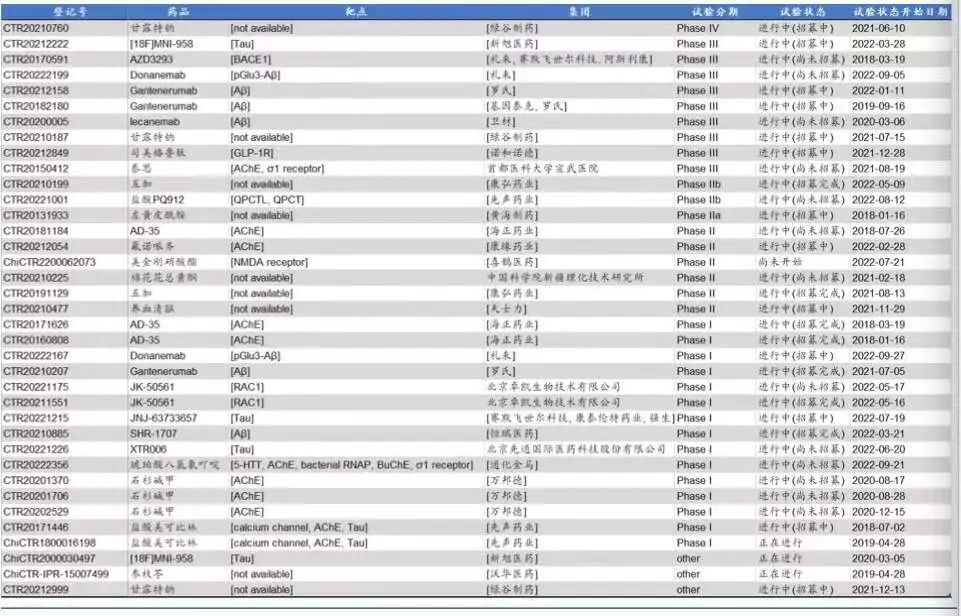
国内方面,上海绿谷制药的阿尔茨海默症创新药九期一(GV-971)于2019年在国内附条件获批上市。在研管线方面,截至2022年,国内已有 37 项针对阿尔茨海默病的临床试验正在进行,其中多家已进入三期临床阶段。
国内阿尔茨海默病药物临床试验(截至2022年)

 产业资讯
产业资讯
 识林
识林  2025-07-03
2025-07-03
 12
12

 产业资讯
产业资讯
 村夫日记LatitudeHealth
村夫日记LatitudeHealth  2025-07-03
2025-07-03
 13
13

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-07-03
2025-07-03
 13
13